
| A. | 在c(H+)=10-13mol/L的溶液中:NH4+、Al3+、Fe3+、NO3- | |
| B. | pH值为1的溶液:Cu2+、Na+、Mg2+、NO3- | |
| C. | 水电离出来的c(H+)=10-3mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| D. | 溶有NaHSO4的溶液中:K+、SO42-、NO3-、Al3+ |
分析 溶液无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.该溶液中存在大量氢氧根离子,铁离子为有色离子,铁离子、铝离子和铵根离子都与氢氧根离子反应;
B.铜离子为有色离子,不满足溶液无色的条件;
C.该溶液中存在大量氢离子或氢氧根离子,碳酸氢根离子与氢离子、氢氧根离子反应;
D.四种离子之间不反应,都不与硫酸氢钠反应.
解答 解:无色溶液时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.在c(H+)=10-13mol/L的溶液中存在大量氢氧根离子,NH4+、Al3+、Fe3+与氢氧根离子反应,Fe3+为有色离子,在溶液中不能大量共存,故A错误;
B.Cu2+为有色离子,不满足溶液无色的要求,故B错误;
C.水电离出来的c(H+)=10-3mol/L的溶液呈酸性或碱性,溶液中存在大量氢离子或氢氧根离子,HCO3-与氢离子和氢氧根离子反应,在溶液中一定不能大量共存,故C错误;
D.K+、SO42-、NO3-、Al3+之间不反应,都不与NaHSO4反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”等;试题侧重对学生基础知识的训练和检验,有利于培养学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:解答题

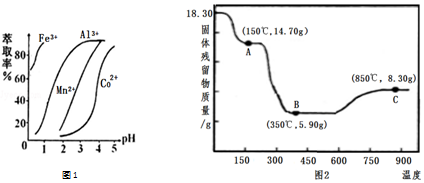
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若开始时开关K与a连接,其反应与铁的吸氧腐蚀类似 | |
| B. | 若开始时开关K与b连接,则标准状况下B极产生2.24 L气体,转移电子0.2 mol | |
| C. | 若开始时开关K与b连接,则该装置是化学能转变为电能 | |
| D. | 若开始时开关K与b连接,其原理类似于钢铁防护中外加电流的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 得乙烯进入酸性KMnO4溶液和溴水,实验现象和反应类型相同 | |
| B. | 从苯的分子组成看苯远没有达到饱和,所以它应该能使溴的CCl4溶液褪色 | |
| C. | 苯环上的碳碳键是一种介于碳碳单链和碳碳双键之间的独特的键,但苯可以发生取代反应和加成反应 | |
| D. | 常温下,所有的碳原子数大于等于5的烷烃都不是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用物质C表示的反应的平均速率为0.3 mol•L-1•s-1 | |
| B. | 反应开始到2 s,物质B的物质的量浓度减少了0.85 mol/L | |
| C. | 2 s时物质A的转化率为15% | |
| D. | 2v(A)=v(B) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
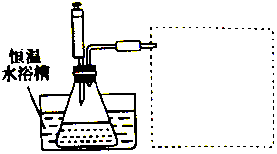 某学习小组的同学利用实验的方法探究一定温度下,双氧水浓度、催化剂用量(浓度)对H2O2分解速率的影响,实验内容如表所示,实验装置如图所示:
某学习小组的同学利用实验的方法探究一定温度下,双氧水浓度、催化剂用量(浓度)对H2O2分解速率的影响,实验内容如表所示,实验装置如图所示:| 实验序号 | 参加反应的物质 | 收集amL(在标准状况下)O2所需时间/s | ||||
| 酸性Fe2(SO4)3溶液 | H2O2溶液 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| ① | 4 | 0.1 | 3 | 4 | 3 | t1 |
| ② | 4 | 0.1 | 2 | 4 | V1 | 5 |
| ③ | V2 | 0.1 | V3 | 4 | 2 | t3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①和③ | C. | 只有② | D. | 只有④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com