
| A. | 碘升华 | B. | 无色透明的水晶被粉碎 | ||
| C. | 蔗糖溶于水 | D. | HCl气体加压降温液化 |
科目:高中化学 来源: 题型:选择题
| A. | 使多糖水解 | B. | 使油脂水解 | C. | 使氨基酸变性 | D. | 使蛋白质变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和甲苯都能与溴水、H2反应 | |
| B. | 聚乙烯的结构简式为CH2=CH2 | |
| C. | 甲苯既能使溴的水溶液褪色,又能在光照下与溴蒸气发生取代反应 | |
| D. | 可用酸性高锰酸钾溶液鉴别乙烯和甲烷或除去甲烷中的乙烯 |
查看答案和解析>>
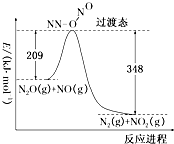
科目:高中化学 来源: 题型:解答题
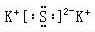 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 | |
| B. | 温度、压强一定时,熵增加的反应一定能自发进行 | |
| C. | 反应焓变是决定反应能否自发进行的唯一因素 | |
| D. | 固体的溶解过程只与焓变有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | 只有①③④⑤ | C. | ②③④⑤⑦ | D. | 只有①③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2FeO4具有强氧化性,可用作水处理剂 | |
| B. | 氢氧化铝具有弱碱性,可用作制胃酸中和剂 | |
| C. | 碳具有还原性,可用作锌锰干电池的正极材料 | |
| D. | 常温下浓硫酸能使铝发生钝化,可用铝制容器贮运浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com