
下列化合物的俗称与化学式不对应的是
A.绿矾-FeSO4·7H2O B.芒硝-Na2SO4·10H2O
C.明矾-Al2(SO4)3·12H2O D.胆矾-CuSO4·5H2O
科目:高中化学 来源:2015-2016学年江西省高一上学期第二次月考化学试卷(解析版) 题型:选择题
在甲、乙两烧杯溶液中,分别含有大量的Cu2+、 K+、 H+、 Cl-、 CO32-、OH- 六种离子中的三种,已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是
A.Cu2+、H+、Cl- B.Cl-、CO32-、OH- C.K+、H+、 Cl- D.K+、CO32-、OH-
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省张掖市高三上第一次诊断考试理综化学试卷(解析版) 题型:填空题
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续地生产。请回答下列问题:
(1)已知:N2(g)+O2(g) =2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g)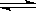 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
则NH3催化氧化生成NO和H2O(g)的热化学反应方程式可表示为: 。
(2)某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g) 2NH3(g)反应的影响,实验结果可表示成如右图所示的规律(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响,实验结果可表示成如右图所示的规律(图中T表示温度,n表示物质的量):
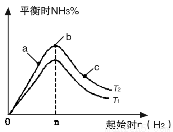
①比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是 。
②在起始时体系中加入N2的物质的量为1mol。若容器容积
为2L,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K= 。
③图像中T1和T2的关系是:T1 T2。(填“>”“<”“=”“无法确定”)
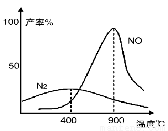
(3)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如下图):
4NH3+5O2 4NO+6H2O ;
4NO+6H2O ;
4NH3+3O2 2N2+6H2O
2N2+6H2O
温度较低时以生成 为主,温度高于900℃时,NO产率下降的原因 。
(4)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
①一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)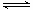 4NO2(g)+O2(g) △H>0,下表为反应在T1温度下的部分实验数据:
4NO2(g)+O2(g) △H>0,下表为反应在T1温度下的部分实验数据:
t/s | 0 | 500 | 1000 |
c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内NO2的生成速率可表示为____________________。
②下列情况能说明该反应已达平衡状态的是 。
A.单位时间内生成2mol NO2的同时消耗了lmol N2O5 B.混合气体的颜色不再发生变化
C.混合气体的密度保持不变 D.在绝热恒容的容器中,反应的平衡常数不再变化
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一上12月月考化学试卷(解析版) 题型:填空题
下面三个方法都可以用来制氯气:
①4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
②KClO3+6HCl=3Cl2↑+KCl+3H2O
③KMnO4+HCl(浓)—KCl+MnCl2+Cl2↑+H2O(未配平),
根据以上三个反应,回答有关问题:
(1)反应的②的离子方程式为________________。
(2)反应②中,氧化产物与还原产物的质量比为____________。
(3)请将反应③配平:__KMnO4+__HCl(浓)=__KCl十__MnCl2+__Cl2↑+__H2O
(4)若要制得相同质量的氯气,①②③反应中电子转移的数目之比为_________。
(5)已知反应④:4HCl(g)+O2 2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为________________。
2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上12月月考化学试卷(解析版) 题型:选择题
已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36.常温时下列有关说法正确的是
A.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强
B.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35 mol/L
C.因为H2SO4是强酸,所以反应:CuSO4+H2S===CuS↓+H2SO4不能发生
D.除去工业废水中的Cu2+可以选用FeS作沉淀剂
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏唐徕回民中学高二上10月月考化学卷(解析版) 题型:选择题
化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂:
HIn (溶液) 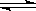 H+(溶液)+In-(溶液)
H+(溶液)+In-(溶液)
红色 黄色
浓度为0.02 mol/L的下列溶液 (1)盐酸 (2)NaOH溶液 (3)NaHSO4溶液 (4)NaHCO3溶液 (5)氨水,其中能使指示剂显红色的是
A.(1)(4)(5) B.(2)(5) C.(1)(3) D.(2)(3)(5)
查看答案和解析>>
科目:高中化学 来源:2016届浙江省深化课程改革协作校高三上学期11月期中联考化学试卷(解析版) 题型:填空题
请回答:
(1)CO2的电子式
(2)将硫化钠溶液与氯化铝溶液混合,有白色沉淀和气体生成,但此沉淀不是硫化铝。写出该反应的离子反应方程式:
(3)将NH3通过灼热的CuO,有无色无味的难溶于水的气体生成,写出该反应的化学方程式:
(4)CoCl2常用作多彩水泥的添加剂,可用钴的某种氧化物与盐酸反应制备(其中Co的化合价为+2、+3)。现取适量这种钴的氧化物,可与480 mL 5 mol·L-1 盐酸恰好完全反应,得到CoCl2溶液和6.72 L黄绿色气体(标准状况)。则该反应的化学反应方程式为 。
Ⅱ下表给出了五种元素的相关信息,其中A、B、C、D为短周期元素。根据以下信息填空:
元素 | 相关信息 |
A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
C | 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
D | 室温下其单质为淡黄色粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
E | 它在地壳中储量丰富,是人体不可缺少的微量元素之一。其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
(5) C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式:____________。
(6)化合物X是元素D的最高价氧化物的水化物,X在水中的电离方程为 ;常温下,E的单质与化合物X反应生成盐Y,Y的化学式是 。化合物Z仅由元素D和E组成, Z+ H2O+ O2= X+ Y,产物中n(X):n(Y)=1:1,写出并配平上述方程式: 。
(7)盐Y受强热会发生分解反应,其气体产物由元素D的氧化物组成,请设计一个可行的定性实验,验证其气体产物中所含元素D的氧化物的组成 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com