
| A. | 用Na2S除去废水中的Hg2+ | B. | 用热的Na2CO3溶液去油污 | ||
| C. | 利用油脂的皂化反应制造肥皂 | D. | 配制CuSO4溶液时加少量稀H2SO4 |
分析 A.硫离子与汞离子结合生成难溶性的HgS;
B.纯碱为强碱弱酸盐,水解呈碱性,油脂在碱性条件下水解;
C.油脂在碱性条件下的水解反应是皂化反应;
D.CuSO4在溶液中水解生成少量H2SO4.
解答 解:A.硫离子与汞离子结合生成难溶性的HgS,所以能用Na2S除去废水中的Hg2+,与与水解反应无关,故A选;
B.纯碱为强碱弱酸盐,水解呈碱性,加热碱性增强,可使油污在碱性条件下水解而除去,与盐类的水解有关,故B不选;
C.油脂在碱性条件下的水解反应是皂化反应,能生成肥皂,所以利用油脂的皂化反应制造肥皂,与盐类的水解有关,故C不选;
D.CuSO4在溶液中水解生成少量H2SO4,加少量稀H2SO4能抑制CuSO4的水解,所以配制CuSO4溶液时加少量稀H2SO4,与盐类的水解有关,故D不选.
故选A.
点评 本题考查盐类水解的应用,侧重于化学知识的综合运用的考查,注意把握盐类水解的原理,题目难度不大.


科目:高中化学 来源: 题型:实验题
| 操作步骤 | 实验现象 | 结论 |
| 取少量I中溶液于试管甲中,滴加品红溶液和盐酸 | 品红始终不褪色 | ①无_SO2(或HSO3-或SO32-)生成 |
| 另取少量I中溶液于试管乙中,加入Ba(OH)2溶液,振荡 | ②白色沉淀 | 有SO42- |
| ③继续在试管乙中滴加Ba(OH)2溶液至过量,静置,取上层清液于试管丙中,________ | 有白色沉淀生成 | 有Cl-生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L C12与足量铁粉反应转移的电子数为0.2NA | |
| B. | 2 L 0.1 mol•L-1Na2CO3溶液中所含CO32-的数目为0.2NA | |
| C. | 28 g C2H4所含共用电子对数目为4NA | |
| D. | 1 mol H2O中所含的中子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加酶洗衣粉洗衣服时水的温度越高越好 | |
| B. | “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关 | |
| C. | 小苏打是制作馒头的膨松剂,苏打是治疗胃酸过多的抗酸剂 | |
| D. | 乙醇、过氧化氢、次氯酸钠等消毒液的消毒原理都是利用其强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素进入人体内会完全水解为葡萄糖从而为人体提供能量 | |
| B. | 含有食品添加剂的食物对人体均有害 | |
| C. | 硫酸铝可除去水体中的悬浮杂质并起到消毒杀菌的作用 | |
| D. | 含氮、磷元素的化合物大量排入江河湖泊中会导致水体富营养化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16 g O2和O3 的混合气体中含有的分子数为0.5 NA | |
| B. | 25℃时,Ksp(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数日为1×10-5 NA | |
| C. | 标准状况下,2.24 L Cl2 通入足量H2O或NaOH溶液中转移的电子数均为0.1 NA | |
| D. | 常温下,1 mol的NaHCO3固体中含HCO3-的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
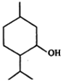
| A. | 薄荷醇分子中至少有12个碳原子共平面 | |
| B. | 薄荷醇分子式为C10H20O,它是环戊醇的同系物 | |
| C. | 1mol薄荷醇与足量NaHCO3反应生成22.4LCO2(标准状况) | |
| D. | 在一定条件下,薄荷醇能发生取代、中和、氧化等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com