
| A.6g | B.8g | C.10g | D.10.2g |


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源:不详 题型:单选题
| A.2/5 mol | B.1/5 mol | C.11/5 mol | D.1/3 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH4 ( g )+2NO2 ( g )= N2( g )+CO2 ( g )+2H2O ( l)△H=一867 kJ·mol-1 |
| B.CH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子总数为3.2 mol |
| C.若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ |
| D.若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总数为3.2 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.10 mol | B.11 mol | C.12 mol | D.13 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2(g)+H2(g) ΔH<0,CO和H2O浓度变化如图所示:
CO2(g)+H2(g) ΔH<0,CO和H2O浓度变化如图所示: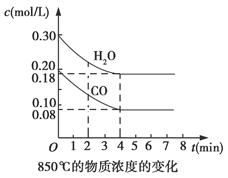
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0. 200 | 0. 300 | 0 | 0 |
| 2 | 0. 138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0. 116 | 0. 216 | 0. 084 | |
| 6 | 0. 096 | 0. 266 | 0. 104 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ·
·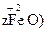 。若处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O,则
。若处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O,则| A.x=1,y=4,z=6 | B.x=0.5,y=1.5,z=8.5 |
| C.x=2,y=4,z=6 | D.x=2,y=6,z=4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com