
将SO2气体通入下列溶液中,能生成白色沉淀且不溶解的是( )
①Ba(OH)2溶液 ②Ba(NO3)2溶液 ③BaCl2溶液
④Ba(ClO)2溶液
A.①② B.①③
C.②④ D.③④
解析:本题考查SO2的性质,意在考查考生对SO2性质的理解能力。①Ba(OH)2溶液中通入SO2,先产生BaSO3沉淀;继续通入SO2,沉淀溶解,转化为Ba(HSO3)2,错误;②Ba(NO3)2溶液中通入SO2,发生反应:2NO +3SO2+2H2O===2NO+3SO
+3SO2+2H2O===2NO+3SO +4H+,Ba2++SO
+4H+,Ba2++SO ===BaSO4↓,总反应为:Ba(NO3)2+3SO2+2H2O===2NO+BaSO4↓+2H2SO4,正确;③BaCl2与SO2不发生反应,错误;④Ba(ClO)2溶液中通入SO2,发生反应:ClO-+SO2+H2O===Cl-+SO
===BaSO4↓,总反应为:Ba(NO3)2+3SO2+2H2O===2NO+BaSO4↓+2H2SO4,正确;③BaCl2与SO2不发生反应,错误;④Ba(ClO)2溶液中通入SO2,发生反应:ClO-+SO2+H2O===Cl-+SO +2H+、Ba2++SO
+2H+、Ba2++SO ====BaSO4↓,总反应为:Ba(ClO)2+2SO2+2H2O===BaSO4↓+2HCl+H2SO4,正确。
====BaSO4↓,总反应为:Ba(ClO)2+2SO2+2H2O===BaSO4↓+2HCl+H2SO4,正确。
答案:C


科目:高中化学 来源: 题型:
下列离子方程式不正确的是 ( )
A.石英与烧碱反应:SiO2+2OH-===SiO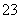 +H2O
+H2O
B.硅与烧碱反应:Si+2OH-===SiO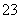 +H2↑
+H2↑
C.硅酸钠溶液中通入少量CO2:SiO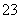 +CO2+H2O===CO
+CO2+H2O===CO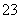 +H2SiO3↓
+H2SiO3↓
D.往水玻璃中加入盐酸:2H++SiO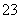 ===H2SiO3↓
===H2SiO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年12月15日4时搭载长征系列火箭的“玉兔号”顺利驶抵月球表面,实现了五星红旗耀月球的创举。火箭升空需要高能燃料,通常用肼(N2H4)作燃料,N2O4做氧化剂。请回答下列问题:
(1)已知:N2(g) + 2O2(g) == 2NO2(g) ΔH= + 67.7kJ·mol-1
N2H4(g) + O2(g)== N2(g) + 2H2O(g) ΔH= - 534.0kJ·mol-1
2NO2(g)  N2O4(g) ΔH= - 52.7kJ·mol-1
N2O4(g) ΔH= - 52.7kJ·mol-1
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: ;
(2)工业上用次氯酸钠与过量的氨气反应制备肼,该反应的化学方程式为: ;
(3)工业上可以用下列反应原理制备氨气:2N2(g)+6H2O(l) 4NH3(g)+3O2(g) ΔH= Q kJ·mol-1
4NH3(g)+3O2(g) ΔH= Q kJ·mol-1
 ①已知该反应的平衡常数K与温度的关系如图,则此反应的Q <
①已知该反应的平衡常数K与温度的关系如图,则此反应的Q <
0
(填“>”“<”或“=”)。
②若起始加入氮气和水,15分钟后,反应达到平衡,此时NH3的浓度为
0.3mol/L,则用氧气表示的反应速率为 。
③常温下,如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时, ABC
(选填编号).
A.容器中气体的平均相对分子质量不随时间而变化 B. v(N2)/v(O2)=2∶3
C.容器中气体的密度不随时间而变化 D.通入稀有气体能提高反应的速率
E.若向容器中继续加入N2,N2的转化率将增大
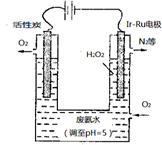 (4)最近华南理工大提出利用电解法制H2O2并以此处理废氨水,装置如图。
(4)最近华南理工大提出利用电解法制H2O2并以此处理废氨水,装置如图。
①为不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约
为5,则所得废氨水溶液中c(NH4+) c(NO3-)(填“>”“<”或
“=”);
②Ir—Ru惰性电极有吸附O2作用,该电极的电极反应为 ;
③理论上电路中每转移3mol电子,最多可以处理NH3·H2O的物质的量
为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个氧化还原反应体系中反应物、生成物共六种粒子,Fe3+、NO 、Fe2+、NH
、Fe2+、NH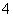 、H+和H2O,下列叙述正确的是( )
、H+和H2O,下列叙述正确的是( )
A.该反应说明Fe(NO3)2溶液不宜加酸酸化
B.该反应中氧化剂与还原剂物质的量之比为81
C.若有1 mol NO 发生氧化反应,则转移电子5 mol
发生氧化反应,则转移电子5 mol
D.若将该反应设计成原电池,则负极反应为Fe3++e-===Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙是三种不含相同离子的可溶性电解质。它们所含的离子如下表所示
| 阳离子 | NH |
| 阴离子 | OH-、NO |
取等质量的三种化合物配制相同体积的溶液,其物质的量浓度:c(甲)>c(乙)>c(丙),下列说法错误的是( )
A.甲中一定含Na+ B.乙中一定含NH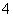
C.丙中一定含Mg2+ D.丙中一定含SO
查看答案和解析>>
科目:高中化学 来源: 题型:
某废水中可能含有下列离子中的若干种:Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO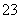 、NO
、NO 、SO
、SO 、SiO
、SiO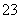 。
。
现进行如下实验:
Ⅰ.取少量溶液,加入KSCN溶液,无明显变化。
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅳ.向Ⅱ中所得的溶液中加入过量浓氨水,仅有红褐色沉淀生成。过滤,在所得滤液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成。
请回答下列问题:
(1)该废水中一定含有的离子是___________________________。
(2)实验Ⅱ中加入少量盐酸生成无色气体的离子方程式是_________________________________________________________。
(3)过滤除去Ⅳ中的蓝色沉淀,调整滤液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为14,其离子方程式为Al+NO +OH-―→AlO
+OH-―→AlO +NH3+N2+H2O(未配平)。还原产物是________。若除去0.2 mol NO
+NH3+N2+H2O(未配平)。还原产物是________。若除去0.2 mol NO ,要消耗铝________g。
,要消耗铝________g。
(4)工业废水中常含有不同类型的污染物,可采用不同的方法处理。下列处理措施和方法中正确的是________。
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 碱性的废水 | 用CO2中和 | 化学法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含复杂有机物的废水 | 通过微生物代谢 | 物理法 |
| D | 废酸 | 加生石灰中和 | 化学法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
溴化碘(IBr)的化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,和某些非金属单质反应生成相应的卤化物,跟水反应的方程式IBr+H2O===HBr+HIO,下列有关IBr的叙述中,不正确的是 ( )
A.IBr是双原子分子
B.在很多反应中,IBr是强氧化剂
C.和NaOH溶液反应生成NaBr和NaIO
D.和水反应时,既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
 右图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是( )
右图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是( )
A.从E口逸出的气体是H2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4 LCl2,便产生2 mol NaOH
D.电解一段时间后加适量盐酸可以恢复到电解前的浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com