
【题目】4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法不正确的是 ( )
A. 与W相邻的同主族元素可制成重要的半导体材料
B. X单质不可能置换出W单质
C. 元素原子半径从大到小的顺序是X、Y、Z
D. W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是HZO4
【答案】B
【解析】四种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-的电子数之差为8。①若W是H元素,则X是He元素,He是稀有气体,不会形成X2+,故舍去;②若W是He元素,则X是Be元素、Z是F元素,其原子的最外层电子数之和为19,则Y最外层电子数是8,Y是Ne,与题意不符,故舍去;③若W是Li元素,则X是C元素、C原子不能形成简单离子,故舍去;④若W是Be元素,则X是O元素、O原子不能形成简单阳离子,故舍去;⑤若W是B元素,则X是Ne元素,Ne是稀有气体,不会形成X2+,故舍去;⑥若W是C元素,则X是Mg元素、Z是Cl元素,其原子的最外层电子数之和为19,则Y最外层电子数是5,为P元素,符合题意。A.根据上述推断,W为C,与C相邻的同主族元素是Si,Si可制成重要的半导体材料,故A正确;B.根据化学反应:2Mg+CO2![]() 2MgO+C,该反应为置换反应,故B错误;C.X、Y、Z分别为Mg、P、Cl,同周期元素从左到右原子半径逐渐减小,则元素原子半径从大到小的顺序是X、Y、Z,故C正确;D.根据上述分析,W是C元素,Y是P元素、Z是Cl元素,元素的非金属性越强,其最高价氧化物对应的水化物酸性越强,所以酸性最强的是HClO4,故D正确;故选B。
2MgO+C,该反应为置换反应,故B错误;C.X、Y、Z分别为Mg、P、Cl,同周期元素从左到右原子半径逐渐减小,则元素原子半径从大到小的顺序是X、Y、Z,故C正确;D.根据上述分析,W是C元素,Y是P元素、Z是Cl元素,元素的非金属性越强,其最高价氧化物对应的水化物酸性越强,所以酸性最强的是HClO4,故D正确;故选B。


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中,然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。下列有关NH4HCO3和HCl反应的说法正确的是
A.NH4HCO3和HCl的反应是放热反应
B.NH4HCO3和HCl的反应是吸热反应
C.反应物的总能量高于生成物的总能量
D.该反应的热化学方程式为NH4HCO3+HCl===NH4Cl+CO2↑+H2O ΔH=+Q kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在火烧圆明园时流失了大量的国宝,如:铜铸的鼠首和兔首。普通铜器时间稍久容易出现铜绿,其主要成分是〔Cu2(OH)2CO3〕,这两件1760年铜铸的国宝在240多年后看上去仍然熠熠生辉不生锈,下列对其原因的分析最可能的是:
A. 它们的表面都电镀上了一层耐腐蚀的黄金
B. 环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去
C. 铜的金属活动性比氢小,因此不易被氧化
D. 它是含一定比例金、银、锡、锌的铜合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见下图,下列说法正确的是( )
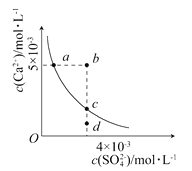
A.在任何溶液中,c(Ca2+)、c(SO42—)均相等
B.b点将有沉淀生成,平衡后溶液中c(SO42—)一定等于3×10-3mol·L-1
C.a点对应的Ksp等于c点对应的Ksp
D.d点溶液通过蒸发可以变到c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生可逆反应:Ni(s)+4CO(g) ![]() Ni(CO)4(g),已知该反应在25℃、80℃时的平衡常数分别为5×104和2,下列说法正确的是( )
Ni(CO)4(g),已知该反应在25℃、80℃时的平衡常数分别为5×104和2,下列说法正确的是( )
A.上述生成Ni(CO)4(g)的反应为吸热反应
B.80℃时,测得某时刻Ni(CO)4(g)、CO(g)浓度均为0.5 mol/L,则此时v(正)<v(逆)
C.恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动
D.恒温恒容下,向容器中再充入少量的Ni(CO)4(g),达到新平衡时CO的百分含量将增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com