
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | 0 |
| 二 | ⑪ | ① | ② | |||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ;
; ;用电子式表示元素②与⑪化合物的形成过程
;用电子式表示元素②与⑪化合物的形成过程 ,该化合物属于共价(填“共价”或“离子”)化合物.
,该化合物属于共价(填“共价”或“离子”)化合物. ;
;分析 由元素在周期表中的位置可知①~⑪分别为N、O、Na、Mg、Al、S、Cl、Ar、K、Br、C,
(1)化学性质最不活泼的原子为Ar;
(2)①元素的单质为氮气;②与⑪形成的化合物为CO2,为共价化合物;
(3)碱性最强的化合物为KOH;
(4)②元素氢化物为水,在常温下和③发生反应所得溶液为氢氧化钠溶液;
(5)元素③与 ⑩形成化合物为NaCl;
(6)元素⑦与⑩分别为Cl和Br,原子序数分别为17、35;
(7)同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大;
(8)同周期元素从左到右元素的金属性逐渐减弱,单质的活泼性逐渐减弱;
(9)可根据单质之间的置换反应判断.
解答 解:由元素在周期表中的位置可知①~⑪分别为N、O、Na、Mg、Al、S、Cl、Ar、K、Br、C,
(1)化学性质最不活泼的原子为Ar,原子核外有3个电子层,最外层电子数为8,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)①元素的单质为氮气,电子式为 ;②与⑪形成的化合物为CO2,形成过程为
;②与⑪形成的化合物为CO2,形成过程为 ,为共价化合物,
,为共价化合物,
故答案为: ;
; ;共价;
;共价;
(3)碱性最强的化合物为KOH,电子式为 ,故答案为:
,故答案为: ;
;
(4)②元素氢化物为水,在常温下和③发生反应所得溶液为氢氧化钠溶液,pH大于7,故答案为:>;
(5)元素③与 ⑩形成化合物为NaCl,焰色反应呈黄色,故答案为:NaCl;黄;
(6)元素⑦与⑩分别为Cl和Br,原子序数分别为17、35,两者核电荷数之差是18,故答案为:18;
(7)同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大,则原子半径K>Br>Cl,故答案为:K>Br>Cl;
(8)同周期元素从左到右元素的金属性逐渐减弱,单质的活泼性逐渐减弱,则活泼性顺序为Na>Mg>Al,可根据与酸反应的剧烈程度判断,
故答案为:Na>Mg>Al;与酸反应的剧烈程度;
(9)氧化性强的单质氯气单质可以将氧化性弱的单质溴单质从其盐中置换出来,即Cl2+2Br-=Br2+2Cl-,故答案为:Cl2+2Br-=Br2+2Cl-.
点评 本题考查了元素周期表和元素周期律综合应用,根据原子结构、物质结构及物质性质、元素周期律等知识来分析解答,熟练掌握并灵活运用元素周期律知识,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 灼烧蚕丝织物有特殊气味 | |
| B. | 女士服用维C美容是利用维C的氧化性 | |
| C. | 将碘酒滴在土豆片上,可观察到蓝色 | |
| D. | 利用油脂在碱性条件下的水解,可以制肥皂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
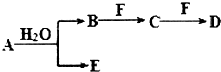 A、B、C、D、E、F为中学化学中的常见物质,且物质A由l~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题:(请用具体的元素符号及化学用语作答)
A、B、C、D、E、F为中学化学中的常见物质,且物质A由l~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题:(请用具体的元素符号及化学用语作答)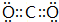 ;D的化学式为NaHCO3.
;D的化学式为NaHCO3. ,D属于共价化合物(填“共价”或“离子”);
,D属于共价化合物(填“共价”或“离子”);查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | A | |||||||
| 二 | D | F | H | |||||
| 三 | B | C | E | G |
 ;化学性质最不活泼的是Ne,A与D形成的阳离子的电子式是
;化学性质最不活泼的是Ne,A与D形成的阳离子的电子式是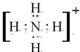 .
.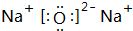 ,
,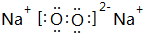 .其中B元素的原子与氧原子按1:1的个数比形成的化合物11.7g与足量二氧化碳完全反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2,有0.15mol 电子发生转移.
.其中B元素的原子与氧原子按1:1的个数比形成的化合物11.7g与足量二氧化碳完全反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2,有0.15mol 电子发生转移.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=C(CH2CH3)C (CH3)3 | B. | CH2=C(CH3)C(CH3)2CH2CH3 | ||
| C. | HC≡CCH(CH3)C(CH3)3 | D. | (CH3)3CC(CH3)=CHCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com