


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源:不详 题型:实验题

| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.新制的漂白粉是纯净物 |
| B.液氯可以使干燥的红色纸片褪色 |
| C.新制氯水光照有O2产生 |
| D.氢氟酸可保存在密封的细口玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| | A | B | C | D |
| X | Cl2 | SO2 | CO2 | NH3 |
| Y | 饱和NaHSO3溶液 | 饱和NaHCO3溶液 | Na2SO3溶液 | 浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氢气在氯气中燃烧产生苍白色火焰 |
| B.红热的铁丝在氯气中燃烧,火星四射,生成黑色固体颗粒 |
| C.红热的铜丝在氯气中燃烧,产生棕黄色烟 |
| D.钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体 |
查看答案和解析>>
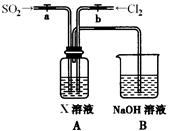
科目:高中化学 来源:不详 题型:实验题
|
|
 试回答:
试回答:查看答案和解析>>
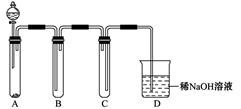
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
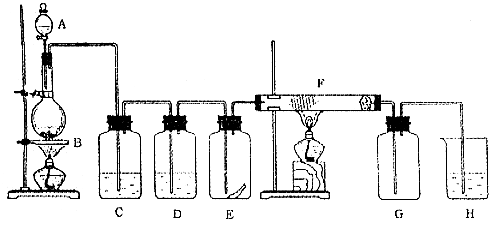
科目:高中化学 来源:不详 题型:实验题
 H++C1-+HClO.反应后所得的溶液漂白性增强的原因是 (用化学平衡移动原理解释)。
H++C1-+HClO.反应后所得的溶液漂白性增强的原因是 (用化学平衡移动原理解释)。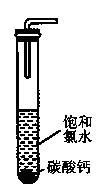
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.漂白粉是混合物,有效成分是Ca(ClO)2 |
| B.光照氯水有气泡逸出,该气体是Cl2 |
| C.Cl2能使湿润的有色布条褪色,说明Cl2具有漂白性 |
| D.实验室用二氧化锰与稀盐酸反应制取Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com