
【题目】化合物A由三种元素组成,某兴趣小组进行了如下实验:

已知:气体甲为纯净物且只含两种元素,在标况下体积为672 mL;溶液乙为建筑行业中常用的粘合剂。
请回答下列问题:
(1)A的组成元素为________(用元素符号表示);
(2)写出气体甲与NaOH(aq)反应的离子方程式________;
(3)高温下,A与足量氯气能发生剧烈爆炸,生成三种常见化合物试写出相应的化学方程式________。
【答案】Mg、Si、H Si2H6 + 4OH- + 2H2O = 2 SiO32- + 7H2↑ MgSi2H4 + 7Cl2 = MgCl2 + 2SiCl4 + 4HCl
【解析】
因溶液乙为建筑行业中常用的粘合剂,则为硅酸钠,根据元素守恒可知,气体甲中含有硅元素,与氢氧化钠恰好完全反应生成气体单质乙,所消耗的氢氧化钠的物质的量为1 mol/L×120×10-3 L = 0.12 mol,根据硅酸钠中Na元素与Si元素的原子个数比为2:1,可知气体甲中含Si的物质的量为0.12mol/2 = 0.06 mol,又知气体甲为纯净物且只含两种元素,在标况下体积为672 mL,即![]() = 0.03 mol,则易知A为0.03 mol,其摩尔质量为
= 0.03 mol,则易知A为0.03 mol,其摩尔质量为![]() = 84 g/mol,且1个气体甲分子中含2个硅原子,同时气体甲与氢氧化钠按物质的量为0.03 mol:0.12 mol = 1:4的反应生成硅酸钠与气体单质乙,根据元素守恒可知气体单质乙中含氢元素,即为氢气。因此气体甲中的另一种元素不能为氧元素,可推知气体甲中的两种元素为硅元素与氢元素。另外,结合溶液甲只有一种溶质,且加入过量的氢氧化钠生成白色沉淀,沉淀受热不易分解,推出白色沉淀为难溶氢氧化物,所用盐酸的物质的量为3 mol/L×20×10-3 L = 0.06 mol, A的质量为2.52 g,化合物A由三种元素组成,推测所含的金属元素为镁,根据Mg
= 84 g/mol,且1个气体甲分子中含2个硅原子,同时气体甲与氢氧化钠按物质的量为0.03 mol:0.12 mol = 1:4的反应生成硅酸钠与气体单质乙,根据元素守恒可知气体单质乙中含氢元素,即为氢气。因此气体甲中的另一种元素不能为氧元素,可推知气体甲中的两种元素为硅元素与氢元素。另外,结合溶液甲只有一种溶质,且加入过量的氢氧化钠生成白色沉淀,沉淀受热不易分解,推出白色沉淀为难溶氢氧化物,所用盐酸的物质的量为3 mol/L×20×10-3 L = 0.06 mol, A的质量为2.52 g,化合物A由三种元素组成,推测所含的金属元素为镁,根据Mg![]() 2HCl可知,一个分子A中含1个镁原子,再根据分子组成可确定A中所含氢原子的个数为84-1×24-2×28 = 4,据此分析作答。
2HCl可知,一个分子A中含1个镁原子,再根据分子组成可确定A中所含氢原子的个数为84-1×24-2×28 = 4,据此分析作答。
根据上述分析可知,
(1)A的组成元素为Mg、Si、H,
故答案为Mg、Si、H;
(2)气体甲为Si2H6与NaOH(aq)按1:4发生氧化还原反应,其离子方程式为:Si2H6 + 4OH- + 2H2O = 2 SiO32- + 7H2↑,
故答案为:Si2H6 + 4OH- + 2H2O = 2 SiO32- + 7H2↑;
(3)根据元素组成及化学方程式中元素守恒推知,在高温下,A与足量氯气能发生剧烈爆炸,生成三种常见化合物为MgCl2 、SiCl4和HCl,则其反应方程式为:MgSi2H4 + 7Cl2 = MgCl2 + 2SiCl4 + 4HCl,
故答案为:MgSi2H4 + 7Cl2 = MgCl2 + 2SiCl4 + 4HCl


科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在2 L固定容积的密闭容器中发生反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列正确的是( )
4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列正确的是( )

A. 0-20 s内平均反应速率v(N2O5)="0.1" mol·L-1·s-1
B. 10 s时,正、逆反应速率相等,达到平衡
C. 20 s时,正反应速率大于逆反应速率
D. 曲线a表示NO2的物质的量随反应时间的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是
A. 少量SO2气体通入次氯酸钠溶液中:SO2+3ClO-+H2O=SO42-+Cl-+2HClO
B. 氧化铁溶于HI溶液:Fe2O3+6H+=2Fe3++3H2O
C. 碳酸氢钠与过量Ba(OH)2溶液反应:HCO3-+OH-+Ba2+=BaCO3![]() +H2O
+H2O
D. 向硅酸钠水溶液中通入过量CO2气体:SiO32-+2H2O+2CO2=2HCO3-+H2SiO3![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 5.6gFe和足量的盐酸完全反应失去电子数为0.2NA
B. 22.4LSO2含有NA个SO2分子
C. 1.6gCH4所含的电子数为NA
D. 标况下,4.48L的水中含有H2O分子的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(g)+nB(g)![]() pC(g)+qD(g)经10 min后达到平衡,测得此时A的浓度减少了nmol/L,C的浓度增加了2n/3mol/L,又知,平均反应速率VC=2VB.达到平衡后,若保持温度不变,缩小容器体积,A的转化率不变,则该反应的化学方程式应为
pC(g)+qD(g)经10 min后达到平衡,测得此时A的浓度减少了nmol/L,C的浓度增加了2n/3mol/L,又知,平均反应速率VC=2VB.达到平衡后,若保持温度不变,缩小容器体积,A的转化率不变,则该反应的化学方程式应为
A. 2A(g)+6B(g)![]() 3C(g)+5D(g)
3C(g)+5D(g)
B. 3A(g)+B(g)![]() 2C(g)+2D(g)
2C(g)+2D(g)
C. 3A(g)+B(g)![]() 2C(g)+D(g)
2C(g)+D(g)
D. A(g)+3B(g)![]() 3C(g)+3D(g)
3C(g)+3D(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如下图所示步骤进行操作(注意事项:①所加试剂必须过量;②过量试剂必须除去;③不能引入新的杂质)。

回答下列问题:
(1)试剂Ⅰ的化学式为______,①中发生反应的离子方程式为_________。
(2)试剂Ⅱ的化学式为_______,②中加入试剂Ⅱ的目的是____________。
(3)试剂Ⅲ的名称是________,③中发生反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置进行脱硫,将硫化氢气体转化成硫沉淀。已知甲、乙池中发生的反应为(右图):下列说法正确的是
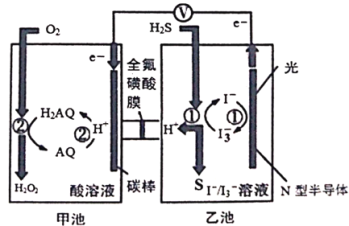
A. 甲池中得到H2O2的反应,H2O2既是氧化产物也是还原产物
B. 电路中每转移0.2mol电子,甲池溶液质量变化3.4g,乙池溶液质量保持不变
C. 光照时乙池电极上发生的反应为:H2S+I3-=3I-+S+2H+
D. 甲池中炭棒上发生的电极反应为:AQ+2H+-2e-=H2AQ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g) +Y(g)![]() 2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法不正确的是( )
A. 反应前2min的平均速率v(Z)=4.0×10-3mol/(L·min)
B. 其他条件不变,升高温度,反应达到新平衡前v(正)<v(逆)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com