
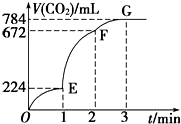
 用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积),下列分析正确的是( )
用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积),下列分析正确的是( )| A. | OE段表示的平均速率最快 | |
| B. | EF段,用盐酸表示该反应的平均反应速率为0.4 mol•L-1•min-1 | |
| C. | OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7 | |
| D. | F点收集到的CO2的量最多 |
分析 A、斜率表示反应速率,斜率越大反应速率越大;
B、根据EF段生成二氧化碳的体积计算氯化氢的物质的量的变化量,进而计算氯化氢浓度变化,根据v=$\frac{△c}{△t}$计算用盐酸表示该反应的平均反应速率;
C、各段终点与起点的纵坐标差值为各段生成的二氧化碳的体积,体积之比等于反应速率之比;
D、由图可知,G点收集784mL气体,反应结束.
解答 解:A、斜率表示反应速率,斜率越大反应速率越大,由图可知,EF段斜率最大,所以EF段反应速率最大,故A错误;
B、由图可知EF段生成的二氧化碳的体积为672ml-224ml=448ml,所以二氧化碳的物质的量为$\frac{0.448L}{22.4L/mol}$=0.02mol,根据CaCO3+2HCl═CaCl2+CO2↑+H2O,可知参加反应的氯化氢的物质的量为0.04mol,所以盐酸的浓度变化量为$\frac{0.04mol}{0.1L}$=0.4mol/L,所以EF段用盐酸表示该反应的平均反应速率为$\frac{0.4mol/L}{1min}$=0.4mol/(L•min),故B正确;
C、OE、EF、FG三段生成的二氧化碳体积分别为224ml、448ml、112ml,所以OE、EF、FG三段中,该反应用CO2表示的平均反应速率之比为224ml:448ml:112ml=2:4:1,故C错误;
D、由图可知,G点收集784mL气体,反应结束,则G点表示收集的CO2的量最多,故D错误.
故选:B.
点评 本题考查反应速率计算、比较等,旨在考查学生对图表的理解,题目难度不大,注意浓度(物质的量)与时间图象,斜率表示反应速率.


科目:高中化学 来源: 题型:选择题
| A. | 1L该溶液中含KNO3 101g | |
| B. | 100mL该溶液中含KNO3 0.01mol | |
| C. | 从1L该溶液中取出500mL后,剩余溶液的浓度为0.05mol/L | |
| D. | 1L水中溶解0.1mol KNO3,即可配得0.1mol/L KNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 酸溶液 | c(NaOH) |
| A | pH=1的硫酸 | 0.4mol/L |
| B | pH=1的硝酸 | 0.4mol/L |
| C | 0.1mol/L的硫酸 | 0.2mol/L |
| D | 0.1mol/L的盐酸 | 0.2mol/L |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥⑦⑧⑨ | B. | ②④⑥⑦⑧⑨ | C. | ①④⑥⑧ | D. | ①②④⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核都是由质子和中子构成 | |
| B. | 质子数相同的粒子其化学性质不一定相同 | |
| C. | 某种粒子最外层上有8个电子,则一定是稀有气体元素的原子 | |
| D. | 原子电子构型为ns2np6的为稀有气体元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳及化合物与人类的关系非常密切,对碳单质及其化合物的研究具有重要意义.
碳及化合物与人类的关系非常密切,对碳单质及其化合物的研究具有重要意义. 2Na2CO3+C;CO32-的空间构型为平面正三角形(用文字描述).
2Na2CO3+C;CO32-的空间构型为平面正三角形(用文字描述).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com