
| A. | 全部 | B. | ③④ | C. | ①②③ | D. | ②③④ |
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:填空题
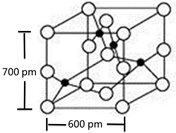 X、Y、M、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;M是周期表中电负性最大的元素;Z基态原子的M层是K层电子数的3倍;R2+离子的3d轨道中有9个电子.请回答下列问题:
X、Y、M、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;M是周期表中电负性最大的元素;Z基态原子的M层是K层电子数的3倍;R2+离子的3d轨道中有9个电子.请回答下列问题: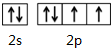 ;Z所在周期中第一电离能最大的主族元素是氯(元素名称)
;Z所在周期中第一电离能最大的主族元素是氯(元素名称)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝投入NaOH溶液中:2Al+2OH-+H2O═2AlO2-+2H2↑ | |
| B. | 石英与烧碱反应:SiO2+2OH-═SiO32-+H2O | |
| C. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 向小苏打溶液中加入过量Ba(OH)2:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
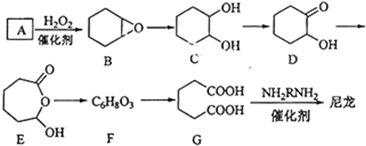
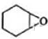 +H2O→
+H2O→ (不需注明条件,其他无机试剂任选).
(不需注明条件,其他无机试剂任选). .
.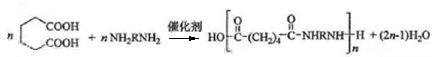 .
.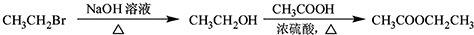
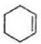 $\stackrel{溴的四氯化碳溶液}{→}$
$\stackrel{溴的四氯化碳溶液}{→}$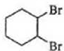 $→_{△}^{氢氧化钠/醇}$
$→_{△}^{氢氧化钠/醇}$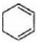 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、OH-、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Al3+、Cl-、NO3- | B. | Al3+、Mg2+、SO42-、OH- | ||
| C. | Fe2+、H+、K+、MnO4- | D. | Cu2+、H+、Cl-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com