
2013年9月,中国华北华中地区发生了严重的雾霆天气,北京?河北?河南等地的空气污染升为6级空气污染,属于重度污染?汽车尾气?燃煤废气?冬季取暖排放的CO2等都是雾霆形成的原因?
(1)汽车尾气净化的主要原理为; , 在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态?
, 在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态?
①能判断该反应达到平衡状态的标志是 ?
| A.在单位时间内生成1molCO2的同时消耗了lmolCO |
| B.混合气体的密度不再改变 |
| C.混合气体的平均相对分子质量不再改变 |
| D.混合气体的压强不再变化 |


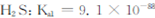 ;
; ?
? ;
;  ?)
?)  ,现将不同量的CO(g)和H20(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
,现将不同量的CO(g)和H20(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据: 
 0(填“<”或“>”);
0(填“<”或“>”); )(1)①CD(2分)
② (2分) 
(2) ①高温(1分) ② (2分)
(2分)
(3) ①2.67(2分) ②a<b(1分) ③<(1分)
解析试题分析:对于一个可逆反应,反应达到平衡的标志为正反应速率等于逆反应速率,各物质的浓度保持不变。A应为.在单位时间内生成1molCO2的同时生成了2molCO,该反应反应物和生成物都是气体,且都是在密闭容器中进行,因此在任何的时刻其密度都保持不变,因此不能用来判断该反应达到了平衡。体积扩大两倍,说明各物质的浓度均减小,速率也会随之降低。由吉布斯自由能小于零是自发进行的反应可知该反应需要在高温下才能够自发进行。煤气化过程中产生的有害气体H2S可用足量的Na2C03溶液吸收,该反应的离子方程式为 。据题意可知,达到平衡时消耗了1.6摩尔的一氧化碳和1.6摩尔的水,生成了1.6摩尔的二氧化碳和1.6摩尔的氢气,由此可知在平衡时,一氧化碳物质的量为2.4摩尔,水物质的量为0.4摩尔,氢气和一氧化碳物质的量都为1.6摩尔,再据化学平衡常数计算公式可知K为2.67.要使CO的转化率大于水蒸气,则水蒸气的量为过量,因此a<b,据题意可知升高温度,达到平衡时,氢气物质的量会减小,因此可知升高温度,反应向逆反应方向进行,因此该反应为放热反应。
。据题意可知,达到平衡时消耗了1.6摩尔的一氧化碳和1.6摩尔的水,生成了1.6摩尔的二氧化碳和1.6摩尔的氢气,由此可知在平衡时,一氧化碳物质的量为2.4摩尔,水物质的量为0.4摩尔,氢气和一氧化碳物质的量都为1.6摩尔,再据化学平衡常数计算公式可知K为2.67.要使CO的转化率大于水蒸气,则水蒸气的量为过量,因此a<b,据题意可知升高温度,达到平衡时,氢气物质的量会减小,因此可知升高温度,反应向逆反应方向进行,因此该反应为放热反应。
考点:考查化学反应与化学平衡的相关知识点。


科目:高中化学 来源: 题型:单选题
向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时, 按正反应速率由大到小的顺序排列,正确的是
①500 ℃, 10 mol SO2和5 mol O2反应
②500 ℃, 用V2O5作催化剂, 10 mol SO2和5 mol O2反应
③450 ℃, 8 mol SO2和5 mol O2反应
④500 ℃, 8 mol SO2和5 mol O2反应。
| A.②①④③ | B.②①③④ | C.①②③④ | D.④③②① |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定条件下,将 两种气体通入密闭容器中,反应按
两种气体通入密闭容器中,反应按

 进行,2秒钟后反应速率如下:
进行,2秒钟后反应速率如下: ,
, ,
, ,则x、y的值分别为( )
,则x、y的值分别为( )
| A.3和2 | B.1和3 | C.3和1 | D.4和5 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某可逆反应L(s) + G(g)  3R(g) △H>0,下图表示外界条件温度、压强的变化对上述反应的影响。试判断图中y轴可以表示( )
3R(g) △H>0,下图表示外界条件温度、压强的变化对上述反应的影响。试判断图中y轴可以表示( )
| A.平衡混合气中R的质量分数 | B.达到平衡时G的转化率 |
| C.平衡混合气中G的质量分数 | D.达到平衡时L的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)(1)氢是未来最好的能源选择,制取氢气的成熟的方法有很多,利用甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g) + H2O(g)  CO2(g) + 3H2(g)
CO2(g) + 3H2(g) 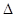 H(298K)=+ 49.4 kJ/mol
H(298K)=+ 49.4 kJ/mol
一定条件下,向容积为2L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),实验测得:达到平衡状态时,吸收热量19.76 kJ。则
①达平衡时混合气体的压强是反应前的 倍。
②该条件下的该反应的平衡常数是 (结果保留两位有效数字)。
③该条件下反应达平衡状态的依据是(填序号) 。
| A.v正(CH3OH)=v正(CO2) | B.混合气体的密度不变 |
| C.c(CH3OH)=c(H2O) | D.混合气体的总物质的量不变 |
 2SO3(g)
2SO3(g) 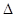 H<0,甲、乙起始反应温度相同,均和外界无热量交换,平衡时,甲中SO2的转化率为a,乙中SO3的分解率为b,则a、b的关系为a+b _______ 1(填“﹤”、“﹥”或“=”) 。
H<0,甲、乙起始反应温度相同,均和外界无热量交换,平衡时,甲中SO2的转化率为a,乙中SO3的分解率为b,则a、b的关系为a+b _______ 1(填“﹤”、“﹥”或“=”) 。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分) )氮元素有着多变价态和种类繁多的化合物,因在生产、生活中发挥着重要的作用。完成下列问题:
(1)在一密闭容器中,进行如下化学反应:
N2(g)+3H2(g) 2NH3(g) △H<0,其化学平衡常数K与温度T的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与温度T的关系如下表:
| T | 298 K | 398 K | 498 K | … |
| K | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(11分)
(1)在一密闭的2 L的容器里充入8 mol SO2和4 mol18O2,在一定条件下开始反应:
2SO2(g)+O2(g) 2SO3(g)2 min末测得容器中有7.2 mol SO2。试回答:
2SO3(g)2 min末测得容器中有7.2 mol SO2。试回答:
①反应后18O原子存在于哪些物质中________
②2 min末SO3的浓度为________
③用O2的浓度变化表示该时间段内的化学反应速率为________
(2)基本化工原料苯和乙烯,都有着十分广泛的用途。请回答:
①可以用来鉴别苯蒸气和乙烯的试剂是________(填序号)
A.水 B.溴的四氯化碳溶液 C.酸性高锰酸钾溶液 D.氢气
②苯分子具有平面正六边形结构,所有原子共平面,则苯分子中在一条直线上的原子最多有________个
(3)下列营养物质在人体内发生的变化及其对人的生命活动所起的作用不正确的是
A.人体中的糖类、油脂和蛋白质都能为人的生命活动提供能量
B.淀粉和纤维素 葡萄糖
葡萄糖 CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
C.油脂 甘油和高级脂肪酸
甘油和高级脂肪酸 CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
D.蛋白质 氨基酸
氨基酸 人体所需的蛋白质(人体生长发育、新陈代谢)
人体所需的蛋白质(人体生长发育、新陈代谢)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为 。
②图中A、B、C、D四个区域,生成铁锈最多的是 (填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为 。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为 。
③上述生产流程中,能体现“绿色化学”思想的是 (任写一项)。
(3)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)= 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com