
 无水芒硝(Na2SO4)与硫化钠(Na2S)是用化工和能源重化工的基础原料,工业上常用天然气、焦炭及氢气等还原法由芒硝制取硫化钠.
无水芒硝(Na2SO4)与硫化钠(Na2S)是用化工和能源重化工的基础原料,工业上常用天然气、焦炭及氢气等还原法由芒硝制取硫化钠.分析 (1)天然气的主要成份是甲烷,碳被氧化生成二氧化碳,说明+6价的硫被还原,化学方程式为CH4+Na2SO4 $\frac{\underline{\;高温\;}}{\;}$Na2S+CO2+2H2O;
(2)应用盖斯定律分析求解;
(3)①温度越高氢气的转化率越大,所以平衡正向移动,正反应是吸热反应;
②700℃时0~2h内,v(H2)=$\frac{△C}{△t}$;根据三行式,求平衡时各组分的浓度,生成物浓度幂之积比上反应物浓度幂之积就得平衡常数;
③为提高芒硝的平衡转化率可采取的措施有:因为正反应是吸热反应,所以可以通过升高温度,两边气体的计量数相等,故不能通过压强的变化,可以通过减少生成物的浓度,使平衡正向移动,来提高转化率;
(4)从环境保护角度考虑,可以从两者反应的产物,分析解答.
解答 解:(1)天然气的主要成份是甲烷,碳被氧化生成二氧化碳,说明+6价的硫被还原,化学方程式为:CH4+Na2SO4 $\frac{\underline{\;高温\;}}{\;}$Na2S+CO2+2H2O,故答案为:CH4+Na2SO4 $\frac{\underline{\;高温\;}}{\;}$Na2S+CO2+2H2O;
(2)根据盖斯定律,Na2SO4(s)+2C(s)=Na2S(s)+2CO2(g)△H1=+225.2kJ•mol-1
CO2(g)+C(s)=2CO(g)△H2=+172.4kJ•mol-1
则Na2SO4(s)+4C(s)=Na2S(s)+4CO(g)△H3=△H1+2△H2=225.2kJ•mol-1+2×172.4kJ•mol-1=570kJ•mol-1,故答案为:570;
(3)①温度越高氢气的转化率越大,所以平衡正向移动,正反应是吸热反应,即△H>0,故答案为:>;
②700℃时0~2h内,氢气浓度的变化量为:0.2mol×85%=0.17mol,v(H2)=$\frac{△C}{△t}$=$\frac{\frac{0.17mol}{2L}}{2h}$=0.0425mol•L-1•h-1,
Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g),
开始浓度:0.1mol/L 0
变化浓度:0.085mol/L 0.085mol/L
平衡浓度:0.015mol/L 0.085mol/L
所以K=$({\frac{0.085}{0.015})}^{4}$=$(\frac{17}{3})^{4}$,故答案为:0.0425;$(\frac{17}{3})^{4}$;
③为提高芒硝的平衡转化率可采取的措施有:因为正反应是吸热反应,所以可以通过升高温度,可以通过减少生成物的浓度,使平衡正向移动,来提高转化率,故答案为:升高温度;及时将生成物中的水蒸从体系中分离;
(4)从环境保护角度考虑,可以从两者反应的产物,甲烷还原CH4+Na2SO4 $\frac{\underline{\;高温\;}}{\;}$Na2S+CO2+2H2O,产生温室气体二氧化碳,而氢气还原Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g),无二氧化碳生成,故答案为:不产生温室气体二氧化碳.
点评 本题考查氧化还原方程式的书写、盖斯定律的应用、化学反应速率、化学平衡常数的计算以及平衡的移动等知识,综合性强,有一定的难度.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁元素 | B. | 铁单质 | C. | 四氧化三铁 | D. | 三氧化二铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
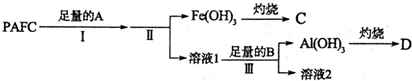
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ②④⑥ | C. | ①③④ | D. | ②④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
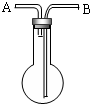 利用如图所示,根据以下8种气体回答:①H2;②O2;③CH4;④HCl;⑤NH3;⑥CO2;⑦H2S;⑧SO2.
利用如图所示,根据以下8种气体回答:①H2;②O2;③CH4;④HCl;⑤NH3;⑥CO2;⑦H2S;⑧SO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常状况下,氨的溶解度不大 | B. | 氨水中的NH3•H2O电离出少量OH- | ||
| C. | 溶于水的氨分子只有少量电离 | D. | 氨本身的弱碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com