二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)利用水煤气合成二甲醚的总反应为:3H
2(g) +3CO(g)

CH
3OCH
3(g)+CO
2(g) △H=- 246.4 kJ/mol 它可以分为两步,反应分别如下:①4H
2(g)+2CO(g)=CH
3OCH
3(g)+H
2O(g) △H1=-205.1 kJ/mol;
②CO(g) +H
2O(g)=CO
2(g) +H
2(g) △H2=____________
(2)在一定条件下的密闭容器中,该总反应达到平衡,只改变一个条件能同时提高反应速率和CO转化率的 是____(填字母代号)。
a.降低温度 b.加入催化剂 c.缩小容器体积 d.增加H
2的浓度 e.增加CO的浓度
(3)在一体积可变的密闭容器中充入3 mol H
2、3 mol CO、1 mol CH
3OCH
3、1 mol CO
2,在一定温度和压强下发生反应:3H
2(g)+3CO(g)
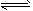
CH
3OCH
3(g)+CO
2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。问:
①反应开始时正、逆反应速率的大小:v(正)_____ (填“>”、“<”或“=”)v(逆)。
②平衡时n(CH
3OCH
3)=_________,平衡时CO的转化率=_________。

 CH3OCH3(g)+CO2(g) △H=- 246.4 kJ/mol 它可以分为两步,反应分别如下:①4H2(g)+2CO(g)=CH3OCH3(g)+H2O(g) △H1=-205.1 kJ/mol;
CH3OCH3(g)+CO2(g) △H=- 246.4 kJ/mol 它可以分为两步,反应分别如下:①4H2(g)+2CO(g)=CH3OCH3(g)+H2O(g) △H1=-205.1 kJ/mol;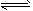 CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。问:
CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。问: 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 (2012?虹口区二模)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)?CH3OCH3(g)+3H2O(g)
(2012?虹口区二模)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)?CH3OCH3(g)+3H2O(g) 已知二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=23.5kJ?mol-1.在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示.请回答下列问题:
已知二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=23.5kJ?mol-1.在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示.请回答下列问题: