
| A. | 在NH4Cl饱和溶液中加入金属镁可以得到两种气体 | |
| B. | pH=12Ba(OH)2溶液中c(OH-)是0.001mol/LNaOH溶液c(OH-)的10倍 | |
| C. | 常温下,CH3COONa和CH3COOH的混合溶液中(pH=7):c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) | |
| D. | 常温下,Cd(OH)2和Co(OH)2的混合悬浊液中,c(Cd2+)是c(Co2+)的4倍,已知:KSP[Cd(OH)2]=7.2×10-15,Ksp[Co(OH)2]=1.8×10-15 |
分析 A.铵根离子水解生,溶液显示酸性,镁与氢离子反应生成氢气,促进了铵根离子的水解,则会生成氨气;
B.温度影响溶液的pH,没有告诉在常温下,无法计算pH=12的氢氧化钡溶液中氢氧根离子浓度;
C.混合液为中性,则c(H+)=c(OH-),结合电荷守恒可得:c(Na+)=c(CH3COO-);
D.同一溶液中,氢氧根离子浓度相等,c(Cd2+)和c(Co2+)的浓度之比等于其溶度积之比.
解答 解:A.在NH4Cl饱和溶液中加入金属镁,镁与铵根离子水解生成的氢离子反应生成氢气,促进了铵根离子的水解,则同时会生成氨气,故A正确;
B.没有告诉温度,则pH=12Ba(OH)2溶液中的氢氧根离子浓度不一定为0.01mol/L,无法判断两溶液中的氢氧根离子浓度大小,故B错误;
C.常温下,CH3COONa和CH3COOH的混合溶液中(pH=7),则c(H+)=c(OH-),结合电荷守恒可得:c(Na+)=c(CH3COO-),则溶液中离子浓度大小为:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-),故C正确;
D.常温下,Cd(OH)2和Co(OH)2的混合悬浊液中氢氧根离子浓度相同,c(Cd2+)与c(Co2+)之比与其溶度积之比相等=$\frac{7.2×1{0}^{-15}}{1.8×1{0}^{-15}}$=4,故D正确;
故选B.
点评 本题考查了离子浓度大小比较、难溶物溶度积的计算、溶液pH的计算等知识,题目难度中等,注意掌握盐的水解原理及其应用,明确电荷守恒、物料守恒、盐的水解原理在判断离子浓度大小中的应用,试题充分考查了学生的分析、理解能力.


科目:高中化学 来源: 题型:选择题
| A. | 电子亚层(能级)是描述电子运动的电子云状态 | |
| B. | 只有在电子层、电子亚层、电子云的伸展方向及电子的自旋都确定时,电子的运动状态才能确定下来 | |
| C. | 必须在B项所述四个方面都确定时,才能决定组成每一能层的最多轨道数 | |
| D. | 电子云伸展方向与能量大小是无关的 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 等物质的量浓度的Na2 C O3和NaHCO3混合液中:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| B. | 25℃时 0.2 mol•L-1盐酸与等体积0.05 mol•L-1Ba(OH)2溶液混合后,溶液的pH=l | |
| C. | pH=3的二元弱酸H2R溶液与pH=ll的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R2-)十c(HR-)=c(Na+) | |
| D. | 25℃时,若0.3 mol•L-1 HY溶液与0.3 mol.L-lNaOH溶液等体积混合后,溶液的 pH=9,则:c(OH-)-c(HY)-c(H+)=1×lO-9 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
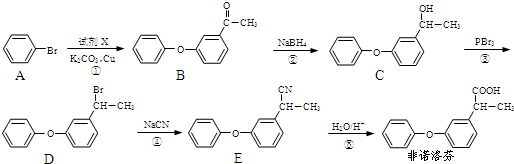
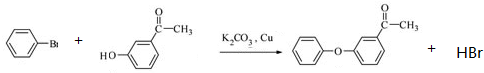 .
.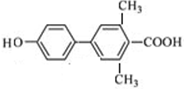 、
、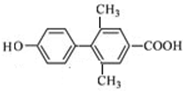 、
、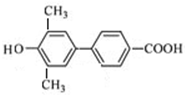 、
、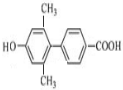 (其中一种).
(其中一种).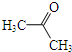 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径r(X)<r(Y),离子半径r(X-)>r(Y2+) | |
| B. | X的简单气态氢化物的稳定性比W的弱 | |
| C. | X分别与Y、W形成的化合物中化学键类型相同 | |
| D. | Z是活泼的金属,其最高价氧化物对应的水合物为强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 产物Cu2HgI4中,Cu元素的化合价为+2 | |
| B. | 由Cu2+与I-直接反应制得CuI的离子方程式为Cu2++I-=CuI | |
| C. | 该反应的氧化剂CuI,氧化产物为Cu | |
| D. | 当有2molCuI参与反应时,转移电子为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2(HCl):饱和食盐水 | B. | H2(H2S、HCl、H2O):碱石灰 | ||
| C. | SO2(HCl):Na2SO3溶液 | D. | CO2(H2S):CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子与原子之间 | B. | 分子与分子之间 | C. | 离子与离子之间 | D. | 离子与电子之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 六方最密堆积是最密堆积,面心立方最密堆积不是最密堆积 | |
| B. | 两者都是最密堆积,其中六方最密堆积是一、三、五…各层球心重合,二、四、六…各层球心重合;面心立方最密堆积是四、五、六…层分别和一、二、三…球心重合 | |
| C. | 原子晶体一般都采用六方最密堆积或面心立方最密堆积 | |
| D. | 只有金属晶体才可能采用六方最密堆积或面心立方最密堆积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com