
分析 (1)同温同压下,相同体积的气体物质的量相同,根据物质的量及分子组成计算原子个数关系;
(2)根据n=$\frac{m}{M}=\frac{V}{{V}_{m}}$计算物质的量、质量,利用N=nNA及物质的构成来计算微粒数;
(3)根据n=$\frac{m}{M}=\frac{V}{{V}_{m}}$,结合摩尔质量与相对分子质量的关系以及分子的组成原子的原子结构计算.
解答 解:(1)同温同压下,相同体积的气体物质的量相同,分子数目相同,则物质的量之比为1:1,分子数之比为1:1;
甲烷的分子式为CH4,1个分子中含有5个原子,二氧化碳的分子式为CO2,1个分子中含有3个原子,相同物质的量的气体原子数之比为5:3;
甲烷的相对分子质量为16,二氧化碳的相对分子质量为44,根据m=nM可知二者质量之比=16:44=4:11,
故答案为:1:1; 1:1; 5:3; 4:11;
(2):①4g氢气的物质的量为:$\frac{4g}{2g/mol}$=2mol,其分子数为2NA,原子数为4NA,质量为4g,标准状况下的体积为2mol×22.4L/mol=44.8L;
②标准状况下11.2L氧气的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,其分子数为0.5NA,原子数为NA,质量为0.5mol×32g/mol=16g,标准状况下的体积为11.2L;
③水的物质的量为1mol,其分子数为NA,原子数为3NA,质量为:1mol×18g/mol=18g,标准状况下水为液体,其体积在三者中最小;
显然分子数最多的是①,原子数最多的是①,质量最大的是③,
故答案为:①;①;③;
(3)1.7g NH3的物质的量为:$\frac{1.7g}{17g/mol}$=0.1mol,标准状况下0.1mol氨气的体积为:V=nVm=0.1mol×22.4L/mol=2.24L;
0.1mol氨气分子中含有氢原子的物质的量为0.3mol,与氨气所含H原子数相同的H2S的物质的量为:$\frac{0.3mol}{2}$=0.15mol,标准状况下0.15mol硫化氢的体积为:0.15mol×22.4L/mol=3.36L,
故答案为:2.24;3.36.
点评 本题考查学生利用以物质的量为中心的计算公式进行简单计算,明确质量、体积、物质的量的关系即可解答,并注意水在标准状况下为液体来解答.


科目:高中化学 来源:2016-2017学年甘肃省高二上第一次学段考试化学卷(解析版) 题型:选择题
我国三峡工程所提供的清洁、廉价、可再生的水电,相当于每年燃烧 3000 万吨原煤的火力发电厂产生的电能,因此三峡工程有助于控制 ①温室效应 ②SO2的排放 ③白色污染 ④臭氧空洞( )
A.①② B.①②③ C.①②④ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
在蒸 发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是( )
发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是( )
A.氯化铝 B.碳酸氢钠 C.硫酸镁 D.高锰酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用如图装置,写出除去下列物质中的杂质的方法,并写出化学方程式(括号内的气体为杂质).
利用如图装置,写出除去下列物质中的杂质的方法,并写出化学方程式(括号内的气体为杂质).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
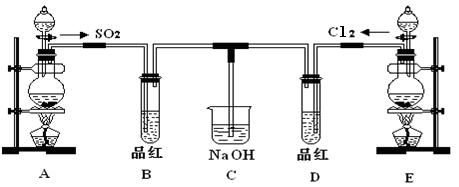
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离产生的c(H+):①=③>④=② | |
| B. | 将②、③溶液混合后,pH=7,消耗溶液的体积:②>③ | |
| C. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量;②最大 | |
| D. | 向溶液中加入100mL水后,溶液的pH:③>④>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①② | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com