
【题目】下列关于有机化合物的说法正确的是( )
A.分子式为C4H8和C2H4的物质一定互为同系物
B.苯乙烯(![]() )使酸性KMnO4溶液和溴水褪色的原理相同
)使酸性KMnO4溶液和溴水褪色的原理相同
C.室温下在水中的溶解度:乙醇>环己烷
D.在酸性条件下,C2H5CO18OC2H5的水解产物是C2H5CO18OH和C2H5OH
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可用于合成除草剂、杀草丹等农药。可通过H2S与CO2在高温下反应制得COS:H2S(g)+CO2(g) ![]() COS(g) +H2O(g) △H > 0。在2 L容器中充入一定量的H2S和CO2发生上述反应,数据如下:
COS(g) +H2O(g) △H > 0。在2 L容器中充入一定量的H2S和CO2发生上述反应,数据如下:
实验 | 温度/℃ | 起始时 | 平衡时 | 平衡 常数 | |||
n(CO2)/mol | n(H2S)/mol | n(COS)/mol | n(H2O)/mol | n(COS)/mol | |||
1 | T1 | 0.200 | 0.200 | 0 | 0 | 0.0200 | K1 |
2 | T2 | 0.200 | 0.200 | 0 | 0 | n2 | K2 =1/36 |
3 | T2 | 0.400 | 0.400 | 0 | 0 | n3 | K3 |
下列判断不正确的是
A. K1=1/81
B. K2 = K3且n3= 2n2
C. 初始反应速率:实验3 gt; 实验2 > 实验1
D. 实验2中平衡时的c(COS)约为0.0286 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 常温下,0.1 mol/L Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S)
B. pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③
C. 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) >c(H+)
D. 向0.1 mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/ c(NH3·H2O)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.二甲醚是一种重要的清洁燃料.合成二甲醚是解决能源危机的研究方向之一.
(1)用CO2和H2可以合成二甲醚(CH3OCH3)
已知:CO(g)+2H2(g)═CH3OH(g)△H1=﹣90.1kJ/mol
CO(g)+H2O(g)═CO2(g)+H2(g)△H2=﹣41.1kJ/mol
2CH3OH(g)═CH3OCH3(g)+H2O(g)△H3=﹣24.5kJ/mol
则反应2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=____________.
(2)二甲醚(CH3OCH3)燃料电池可以提升能量利用率.利用二甲醚酸性介质燃料电池电解200mL饱和食盐水(惰性电极),电解一段时间后,阴极收集到标况下的氢气2.24L(设电解后溶液体积不变)
①二甲醚燃料电池的正极反应式为_____________________________.
②请写出电解食盐水的化学方程式____________________.
③电解后溶液的pH=_________.
II.室温下,0.1 mol·L-l的KOH溶液滴10.00mL 0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
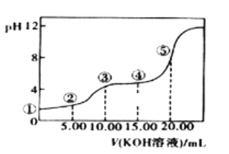
(3)点③所示溶液中所有离子的浓度由大到小的顺序为:___________________。点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O422-)=________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海冰是海水冻结而成的咸水冰。海水冻结时,部分来不及流走的盐分以卤汁的形式被包围在冰晶之间,形成“盐泡”![]() 假设盐分以一个NaCl计
假设盐分以一个NaCl计![]() ,其大致结构如下图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是( )
,其大致结构如下图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是( )
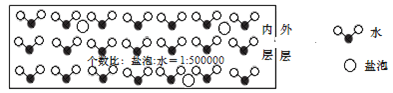
A.海冰内层“盐泡”越多,密度越小
B.海冰冰龄越长,内层的“盐泡”越多
C.海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在
D.海冰内层NaCl的浓度约为![]() 设冰的密度为
设冰的密度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是
A. 已知甲烷的燃烧热为890.3 kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJmol-1
B. 已知强酸和强碱的稀溶液反应的中和热为57.3 kJmol-1,则CH3COOH+OH—=CH3COO—+H2O ΔH=-57.3 kJmol-1
C. 一定条件下,将0.5mol N2和1.5mol H2置于密闭容器中,充分反应生成NH3(g),放出热量19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJmol-1
2NH3(g) ΔH=-38.6 kJmol-1
D. 已知1g N2H4(l)和足量H2O2(l)反应生成氮气和水蒸气,放出热量20.05kJ,该热化学方程式可表示为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.6 kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单斜硫和正交硫转化为二氧化硫的能量变化图如所示。下列说法正确的是![]()
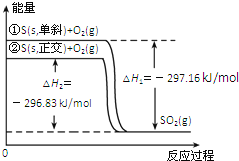
A.![]() ,单斜
,单斜![]() ,正交
,正交![]()
B.正交硫比单斜硫稳定
C.单斜硫燃烧的热化学方程式为:![]() ,单斜
,单斜![]()
D.![]() 式表示断裂1
式表示断裂1 ![]() 中的共价键所吸收的能量比形成1
中的共价键所吸收的能量比形成1 ![]() 中的共价键所放出的能量少
中的共价键所放出的能量少![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中常用MnS作为沉淀剂除去工业废水中Cu2+:Cu2+(aq)+MnS(s) ![]() CuS(s)+Mn2+(aq),下列说法错误的是( )
CuS(s)+Mn2+(aq),下列说法错误的是( )
A.MnS的Ksp比CuS的Ksp大
B.该反应达平衡时c(Mn2+)=c(Cu2+)
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.该反应的平衡常数K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的反应热△H为
Si(s)+4HCl(g),该反应的反应热△H为
A. +236 kJ·mol-1B. -236 kJ·mol-1
C. +412 kJ·mol-1D. -412 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com