
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
 ,故答案为:NaBr;黄;
,故答案为:NaBr;黄; .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、①②③④ | B、②③ |
| C、①②④ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N4属于一种新型的化合物 |
| B、N4与N2的摩尔质量相等 |
| C、等质量的N4与N2所含的原子个数比为1:1 |
| D、等质量的N4与N2所含的原子个数比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、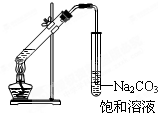 实验室常用如图所示的装置制取少量的乙酸乙酯 |
| B、用热的纯碱溶液洗涤试管内壁附着的油脂 |
| C、棉花在酒精灯的火焰上灼烧后会产生烧焦羽毛味 |
| D、用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 物质的制备、分离、提纯、检验是化学实验中的重要内容,利用所学知识回答下列问题:
物质的制备、分离、提纯、检验是化学实验中的重要内容,利用所学知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com