
| 沉淀 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4•7H2O | 30.9 | 35.5 | 40.8 | 45.6 | -- |
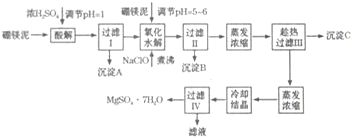
分析 由制备流程可知,硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3等),向废渣中加硫酸时SiO2不溶解,过滤得到A为二氧化硅,NaClO具有氧化性,能将Fe2+氧化为Fe3+,PH=5~6时Fe(OH)3、Al(OH)3生成沉淀,加入硼镁泥调节溶液PH=5-6,煮沸过滤,则沉淀B中除MnO2、SiO2外还含有Fe(OH)3、Al(OH)3,加热煮沸的主要目的是促进Al3+、Fe3+水解,由于CaSO4的溶解度随温度的变化不大,而MgSO4在温度较高时易溶于水,趁热过滤利于分离硫酸钙和硫酸镁,并防止MgSO4在温度低时结晶析出,所以过滤Ⅲ需趁热过滤,过滤得到的沉淀C为CaSO4•2H2O或CaSO4,滤液中主要含硫酸镁,然后蒸发浓缩、冷却结晶、过滤得到MgSO4•7H2O.
(1)氧化亚铁是金属氧化物,亚铁离子有还原性,根据金属氧化物和还原性离子的性质确定氧化亚铁发生的变化;
(2)①NaClO溶液在加热条件下将溶液中的Mn2+氧化成MnO2,本身被还原为氯离子;
②根据表中数据可知Fe3+易水解生成Fe(OH)3沉淀,NaClO具有氧化性,能将Fe2+氧化为Fe3+;
(3)根据表1确定沉淀B的成分,上述分析可知沉淀B中除MnO2、SiO2外还含有Fe(OH)3、Al(OH)3;
(4)根据表2确定沉淀C的成分,根据硫酸镁和温度的关系分析,趁热过滤时,硫酸钙的溶解度较小,而硫酸镁的溶解度较大,易于分离混合物,此时过滤得到的沉淀为CaSO4•2H2O或CaSO4.
解答 解:由制备流程可知,硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3等),向废渣中加硫酸时SiO2不溶解,过滤得到A为二氧化硅,NaClO具有氧化性,能将Fe2+氧化为Fe3+,PH=5~6时Fe(OH)3、Al(OH)3生成沉淀,加入硼镁泥调节溶液PH=5-6,煮沸过滤,则沉淀B中除MnO2、SiO2外还含有Fe(OH)3、Al(OH)3,加热煮沸的主要目的是促进Al3+、Fe3+水解,由于CaSO4的溶解度随温度的变化不大,而MgSO4在温度较高时易溶于水,趁热过滤利于分离硫酸钙和硫酸镁,并防止MgSO4在温度低时结晶析出,所以过滤Ⅲ需趁热过滤,过滤得到的沉淀C为CaSO4•2H2O或CaSO4,滤液中主要含硫酸镁,然后蒸发浓缩、冷却结晶、过滤得到MgSO4•7H2O,
(1)浓硫酸有强氧化性,氧化亚铁是金属氧化物,能和硫酸反应生成盐,所以氧化亚铁能溶解,亚铁离子检验还原性,浓硫酸有强氧化性,所以亚铁离子能被浓硫酸氧化,即氧化亚铁被氧化,
故选:b c;
(2)①NaClO溶液在加热条件下将溶液中的Mn2+氧化成MnO2,反应的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-,
故答案为:Mn2++ClO-+H2O=MnO2↓+2H++Cl-;
②根据表中数据可知Fe3+易水解生成Fe(OH)3沉淀,NaClO具有氧化性,能将Fe2+氧化为Fe3+,易于除杂,反应的方程式为6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-或2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,
故答案为:将Fe2+氧化为Fe3+;6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-或2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;
(3)根据表1知,pH=5-6时,氢氧化铝和氢氧化铁完全生成沉淀,上述分析可知沉淀B中除MnO2、SiO2外还含有Fe(OH)3、Al(OH)3,
故答案为:Fe(OH)3;Al(OH)3;
(4)趁热过滤时,硫酸钙的溶解度较小,而硫酸镁的溶解度较大,易于分离混合物,此时过滤得到的沉淀为CaSO4•2H2O或CaSO4,如不趁热过滤,冷却后硫酸镁的溶解度减小,会生成硫酸镁晶体,
故答案为:CaSO4•2H2O或CaSO4;防止MgSO4在温度降低时结晶析出.
点评 本题考查制备实验方案的设计,为高频考点,把握物质的制备的流程、理解反应原理为解答的关键,涉及物质的制备、除杂,涉及物质的检验以及沉淀的转化等知识,题目较为综合,有一定难度,本题注意要认真分析题中数据,考查学生的分析能力,题目难度中等.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 颜色 | B. | 质量 | C. | 压强 | D. | 密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2 | B. | 2:3 | C. | 11:9 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 配制标准溶液的NaOH中混有Na2CO3杂质 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其他操作正确 | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗 | |
| D. | 滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3固体 | B. | NaCl溶液 | C. | 浓H2SO4 | D. | KNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
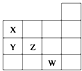 如图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是( )
如图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是( )| A. | ①③ | B. | ①② | C. | ②③ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com