
| A. | 上述四种元素的原子半径大小为W<X<Y | |
| B. | W、X、Y、Z原子的核外最外层电子数的总和为20 | |
| C. | 由W和Y元素组成的化合物不止一种 | |
| D. | 由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
分析 短周期元素W、X、Y、Z的原子序数依次增大,X的一种核素在考古时常用来鉴定一些文物的年代,用的是C14,采用的是断代法,故X为碳;X、Y、Z原子的内层电子数相同,均处于第二周期,W的阴离子的核外电子数与X、Y、Z原子的内层电子数相同,X、Y、Z的内层电子数为2,故W为氢;Z不能形成双原子分子,则Z为Ne;工业上采用液态空气分馏方法来生产Y的单质,Y为N或O元素,据此答题.
解答 解:短周期元素W、X、Y、Z的原子序数依次增大,X的一种核素在考古时常用来鉴定一些文物的年代,用的是C14,采用的是断代法,故X为碳;X、Y、Z原子的内层电子数相同,均处于第二周期,W的阴离子的核外电子数与X、Y、Z原子的内层电子数相同,X、Y、Z的内层电子数为2,故W为氢;Z不能形成双原子分子,则Z为Ne;工业上采用液态空气分馏方法来生产Y的单质,Y为N或O元素.
A.X为C,Y为N或O,同周期元素从左到右元素的原子半径逐渐减小,则原子半径X>Y,Z为Ne,原子半径测定依据不同,一般不与主族元素的原子半径相比较,故A错误;
B.W、X、Y、Z原子的核外最外层电子数的总和为1+4+5+8=18或1+4+6+8=19,故B错误;
C.W与Y可形成烃类物质,种类繁多,故C正确;
D.C和H可形成多种烃类化合物,当相对分子质量较大时,形成的烃在常温下为液体或固体,沸点较高,故D错误.
故选C.
点评 本题主要考查了元素周期律、原子结构、元素化合物知识,中等难度,解题的关键是元素推断,注意常见元素化合物知识的应用.


科目:高中化学 来源: 题型:选择题
| A. | 向沸水中滴加饱和FeCl3溶液制胶体:Fe3++3H2O═Fe(OH)3(胶体)+3H+ | |
| B. | Ba(OH)2溶液与稀H2SO4混合:2H++2OH-═2H2O | |
| C. | 少量铁粉加入稀硝酸中:Fe+NO3-+4H+═Fe2++NO↑+2H2O | |
| D. | 钠放入水中:Na+H2O═Na++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自备购物袋,不用塑料方便袋,可以有效控制“白色污染” | |
| B. | 大力发展、推广可利用太阳能.风能的城市照明系统,能够减少温室气体的排放 | |
| C. | 将液电池深埋,可以避免其中的重金属污染 | |
| D. | 建立空调凝结水和屋面雨水收集系统,充分利用水资源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2014年10月,北京、哈尔滨等多个北方城市出现严重雾霾天气,多所学校被迫停课,造成雾霾的“罪魁”之一是汽车尾气.当今汽车尾气处理主要经三元催化器处理,其主要污染物(CO、NOx,碳氢化合物)可自发的相互反应变成无害气体,减少环境污染,其反应原理之一:2NO(g)+2CO(g)═N2(g)+2CO(g)△H,回答下列问题:
2014年10月,北京、哈尔滨等多个北方城市出现严重雾霾天气,多所学校被迫停课,造成雾霾的“罪魁”之一是汽车尾气.当今汽车尾气处理主要经三元催化器处理,其主要污染物(CO、NOx,碳氢化合物)可自发的相互反应变成无害气体,减少环境污染,其反应原理之一:2NO(g)+2CO(g)═N2(g)+2CO(g)△H,回答下列问题:| 时间/s | 0 | 2 | 3 | 4 |
| C(NO0(×10-4mol•L-1) | 20.0 | 3.00 | 2.00 | 2.00 |
| C(CO)(×10-3mol•L-1) | 2.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,试回答下列各题:
,试回答下列各题: B.
B.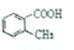 C.
C.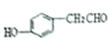 D.
D.



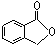
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
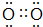 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com