
| A. | 稀硝酸与足量的Fe反应的离子方程式:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| B. | 碳酸氢钙溶液中加入过量的氢氧化钠:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 向碳酸钙中加入稀盐酸的离子方程式:CO32-+2H+═CO2↑+H2O | |
| D. | 硅酸钠溶液中通入过量二氧化碳:CO2+SiO32-+H2O═H4SiO4↓+CO32- |
分析 A.发生氧化还原反应,生成硝酸亚铁、NO和水;
B.反应生成碳酸钠、碳酸钙和水;
C.碳酸钙在离子反应中保留化学式;
D.反应生成硅酸和碳酸氢钠.
解答 解:A.稀硝酸与足量的Fe反应的离子方程式为3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,故A正确;
B.碳酸氢钙溶液中加入过量的氢氧化钠的离子反应为Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O,故B错误;
C.向碳酸钙中加入稀盐酸的离子方程式的离子反应为CaCO3+2H+═Ca2++CO2↑+H2O,故C错误;
D.硅酸钠溶液中通入过量二氧化碳的离子反应为2CO2+SiO32-+3H2O═H4SiO4↓+2HCO3-,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ③ | B. | ①②③ | C. | ③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 叙述 | 判断 |
| A | 1molH2O | 标准状况下,其体积约为22.4L | 正确 |
| B | 2gH2 | 常温常压下,有NA个氢分子 | 错误 |
| C | 1L0.1mol?L-1NaCl溶液 | 取出100mL,NaCl的物质的量浓度为0.1mol?L-1 | 正确 |
| D | 1mol?L-1Na2SO4溶液 | 将1molNa2SO4固体溶于1L水可配得该溶液 | 正确 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
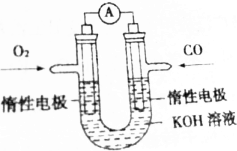 某实验小组将反应2CO(g)+O2(g)═2CO2(g)设计成如图所示的电池装置,负极的电极反应式为CO-2e-+2OH-=CO32-+H2O;正极的电极反应式为O2+2H2O+4e-=4OH-.电池工作时,正极区域溶液的pH变大(填“变大”“变小”或“不变”)用该原电池做电源,电解200mL饱和食盐水(足量),消耗的标准状况下的CO224mL,则溶液的pH=13.(不考虑溶液体积的变化)
某实验小组将反应2CO(g)+O2(g)═2CO2(g)设计成如图所示的电池装置,负极的电极反应式为CO-2e-+2OH-=CO32-+H2O;正极的电极反应式为O2+2H2O+4e-=4OH-.电池工作时,正极区域溶液的pH变大(填“变大”“变小”或“不变”)用该原电池做电源,电解200mL饱和食盐水(足量),消耗的标准状况下的CO224mL,则溶液的pH=13.(不考虑溶液体积的变化)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M+N=P+Q | B. | M+2N=2P+Q | C. | 2M+N=2P+Q | D. | 2M+N=P+2Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
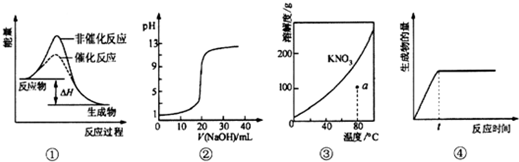
| A. | ①表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | ②表示0.1 mo1•L-1NaOH溶液滴定20 mL 0.1 mo1•L-1HCl溶液所得到的滴定曲线 | |
| C. | ③表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 | |
| D. | 某可逆反应生成物的量随反应时间关系如图④所示,在t时反应物转化率达到最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
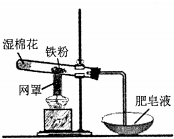
| A. | 该反应属于复分解反应 | |
| B. | 网罩的作用是集中火焰,提高温度 | |
| C. | 湿棉花的作用是给试管降温,防止炸裂 | |
| D. | 反应中水既不是氧化剂,也不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗硅制备单晶硅不涉及氧化还原反应 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位 | |
| C. | 硅的化学性质不活泼,在自然界中可以以游离态存在 | |
| D. | 硅在电子工业中,是重要的半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com