
【题目】关于有机物的叙述正确的是( )
A.丙烷的二卤代物是4种,则其六卤代物是2种
B.某烃的同分异构体只能形成一种一氯代物,其分子式一定为C5H12
C.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
D.对二甲苯的核磁共振氢谱显示有3种不同化学环境的氢
科目:高中化学 来源: 题型:
【题目】在一定条件下,已达平衡的可逆反应:2A(g)+B(g)![]() 2C(g),下列说法中正确的是 ( )
2C(g),下列说法中正确的是 ( )
A. 平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K=![]()
B. 改变条件后,该反应的平衡常数K一定不变
C. 如果改变压强并加入催化剂,平衡常数会随之变化
D. 若平衡时增加A和B的浓度,则平衡常数会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下:
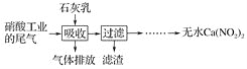
(1)一定条件下,NO与NO2可以生成一种新的氧化物,试写出该反应的化学方程式:___。
(2)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是__;滤渣可循环使用,滤渣的主要成分是__(填化学式)。
(3)该工艺需控制NO和NO2物质的量之比接近1∶1。
若n(NO)∶n(NO2)>1∶1,则会导致__;
若n(NO)∶n(NO2)<1∶1,则会导致__。
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组用酸性 KMnO4 溶液和草酸(H2C2O4)溶液反应,研究外界条件对反应速率的影响,实验操作及现象如下:
编号 | 实验操作 | 实验现象 |
I | 向一支试管中先加入 1 mL 0.01 mol/L 酸 性 KMnO4 溶液,再加入 1 滴 3 mol/L 硫酸和 9 滴蒸馏水,最后加入 1 mL 0.1 mol/L草酸溶液 | 前 10 min 内溶液紫色无明显变化,后颜色逐渐变浅, 30 min 后几乎变为无色 |
II | 向另一支试管中先加入 1 mL 0.01 mol/L 酸性 KMnO4 溶液,再加入 10 滴 3 mol/L硫酸,最后加入 1 mL 0.1 mol/L 草酸溶液 | 80 s 内溶液紫色无明显变 化,后颜色迅速变浅,约 150 s 后几乎变为无色 |
(1)补全高锰酸钾与草酸反应的离子方程式:5H2C2O4 + 2MnO4- + 6H+ =2Mn2+ +_____+_____
(2)由实验 I、II 可得出的结论是_____。
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示。
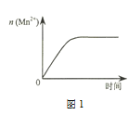
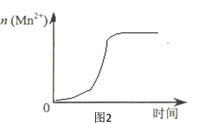
该小组同学根据图2所示信息关于实验II中80 s后溶液颜色迅速变浅的原因,该小组提出了猜想提出了新的猜想,并继续进行实验探究。
Ⅰ.该小组同学提出的猜想是_____。
Ⅱ.请你帮助该小组同学完成实验方案,并填写表中空白。
(实验内容及记录)(H2C2O4 溶液足量)
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间 / min | ||
0.1 mol/L H2C2O4 溶液 | 0.01 mol/L KMnO4 溶液 | 3 mol/L 稀硫酸 | |||
1 | 1.0 | 1.0 | 10 滴 | 无 | 150S |
2 | 1.0 | 1.0 | 10 滴 | _____ | t |
Ⅲ.若该小组同学提出的猜想成立,则 t______“>”“<”“=”) 150S应观察到的现象是_____。
(4)该小组拟采用如图所示的实验方案继续探究外界条件对反应速率的影响。
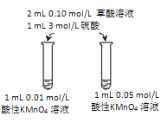
① 他们拟研究的影响因素是_____。
② 你认为他们的实验方案_____(填“合理”或“不合理”),理由是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】塑剂DCHP可由环己醇制得。环己醇和DCHP的结构简式如图所示,下列说法中正确的是
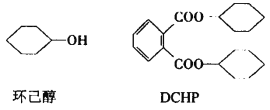
A.DCHP的分子式为C20H24O4
B.环己醇和DCHP的一氯代物均有4种
C.1molDCHP水解时消耗2mol NaOH
D.环己醇分子中的所有碳原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸的工业制备是一个重要的化工生产过程,但在生产过程中会产生大量污染,需要在生产工艺中考虑到绿色工艺.以硫酸工业产生的二氧化硫尾气、氨水、石灰石、焦炭、碳酸氢铵为原料可以合成硫化钙、硫酸铵、亚硫酸铵等物质.合成路线如下:
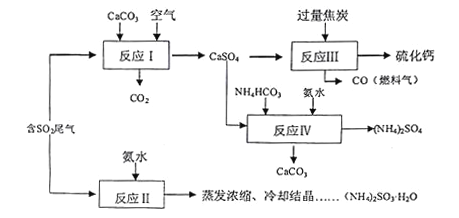
(1)写出反应Ⅰ的化学方程式________________________.
(2)反应Ⅲ中每生成lmol硫化钙理论上转移电子数________;为充分利用副产品CO,有人提出以熔融的K2C03为电解质,设计燃料电池,请写出此电池的负极反应_____________.
(3)为检验反应Ⅱ得到的产品是否因部分被氧化而变质,需选择的化学试剂有__________________.
(4)根据合成流程,可以循环利用的是____________.
(5)(NH4)2SO3溶液可用于电厂产生的烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的离子方程式___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物既是可导致酸雨的物质,也是造成空气污染的重要物质,加大对氮的氧化物的治理是环境保护重要举措。
(1)在一定条件下氨气可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式: _____________________________,该反应中氧化剂是_________,还原剂是________________________________________。
(2)汽车尾气中含有CO和NO,消除这两种物质对大气的污染的方法是安装催化转化器,使它们发生反应生成对大气无污染的气体,该反应的化学方程式为___________________________________。
(3)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH===2NaNO2+H2O
2NO2+2NaOH===NaNO2+NaNO3+H2O
现有VL某NaOH溶液能完全吸收nmol NO2和mmol NO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为_________ mol·L-1。
②若所得溶液中c(NO3-)∶c(NO2-)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=_________。
③用含n和m的代数式表示所得溶液中NO3-和NO2-浓度的比值c(NO3-)∶c(NO2-)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯氧化铁可作现代电子工业材料。以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程示意图。已知当溶液的pH大于6.5,Fe2+开始转化成Fe(OH)2。

(1)步骤Ⅰ中过滤所得滤渣的主要成分是____,工业上可以利用一种弱酸溶解该物质,该弱酸为____。
(2)步骤Ⅱ中加入铁粉的目的是____。
(3)写出步骤Ⅳ中反应的离子方程式____。
(4)在空气中煅烧FeCO3可制备高纯氧化铁,煅烧所需的主要仪器为____(写一种仪器名称),FeCO3在煅烧前应充分洗涤干净,写出实验室洗涤沉淀的方法____。
(5)写出煅烧FeCO3可制备高纯氧化铁反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Calanolide A是一种抗HIV药物,其结构简式如图所示。下列关于Calanolide A的说法错误的是( )
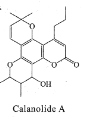
A. 分子中有3个手性碳原子
B. 分子中有3种含氧官能团
C. 该物质既可发生消去反应又可发生加成反应
D. 1mol该物质与足量NaOH溶液反应时消耗1molNaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com