
| V |
| Vm |
| m |
| M |
| 28L |
| 22.4L/mol |
| ||
| 40g/mol×2.5mol |
| 700g-71g/mol×1.25mol-2g/mol×1.25mol |
| 370g |
| 74g/mol |
| 28L |
| 22.4L/mol |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
 将一定质量的镁铝合金投入200mL一定浓度的盐酸中,合金完全溶解,向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:
将一定质量的镁铝合金投入200mL一定浓度的盐酸中,合金完全溶解,向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:查看答案和解析>>
科目:高中化学 来源: 题型:
A、 灼烧 |
B、 过滤 |
C、 分液 |
D、 蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E为周期表中前四周期的元素,其核电荷数依次增大,A、B、C为同一周期元素,AC与B2互为等电子体,D原子中s电子总数与p电子总数相等,且与B能形成离子化合物D3B2,五种元素的核电荷数之和为62.请回答下列问题:
A、B、C、D、E为周期表中前四周期的元素,其核电荷数依次增大,A、B、C为同一周期元素,AC与B2互为等电子体,D原子中s电子总数与p电子总数相等,且与B能形成离子化合物D3B2,五种元素的核电荷数之和为62.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
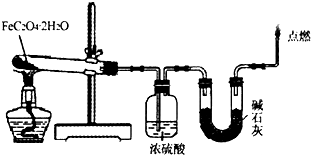 (1)取一定质量H2C2O4?2H2O和KHC2O4的混合物,加水溶解,配成250mL溶液,取两份此溶液各25mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25mol?L-1 NaOH溶液至20.00mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3mol?L-1H2SO4溶液酸化后,用0.10mol?L-1KMnO4溶液滴定,消耗KMnO4溶液16.00mL时达到终点.请回答下列问题
(1)取一定质量H2C2O4?2H2O和KHC2O4的混合物,加水溶解,配成250mL溶液,取两份此溶液各25mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25mol?L-1 NaOH溶液至20.00mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3mol?L-1H2SO4溶液酸化后,用0.10mol?L-1KMnO4溶液滴定,消耗KMnO4溶液16.00mL时达到终点.请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸、浓硝酸都具有强氧化性,不能盛放在金属容器中 |
| B、Na2SiO3是制备硅胶和木材防火剂的原料 |
| C、明矾和漂白粉常用于自来水的净化,两者的作用原理完全相同 |
| D、合金的硬度比纯金属大,熔点也比纯金属高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、298K时在水中溶解能力Mg(OH)2弱于MgCO3 |
| B、MgCO3悬浊液中加入适量的烧碱溶液可以生成Mg(OH)2沉淀 |
| C、沉淀溶解平衡时溶液中的c(Mg2+)=5.6×10-10mol?L-1 |
| D、298时饱和Mg(OH)2溶液与饱和MgCO3溶液相比前者的c(Mg2+)大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com