
(1)已知t ℃时AgCl的Ksp=2×10-10;(2)在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )。
| A.在t ℃时,Ag2CrO4的Ksp为1×10-9 |
| B.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点 |
| C.在t℃时,以0.01 mol/L AgNO3溶液滴定20 mL0.01 mol/LKCl和0.01 mol/L的K2CrO4的混和溶液,Cl-先沉淀 |
| D.在t ℃时,AgCl的溶解度大于Ag2CrO4 |
C
解析试题分析:A、依据 图象曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,Ag2CrO4的沉淀溶剂平衡为:Ag2CrO4(s)?2Ag+CrO42-,Ksp=c2(Ag+)c(CrO42-)=(10-3)2×10-6=10-12,错误;B、在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点,错误;C、依据溶度积常数计算Ksp(CrO42-)=c2(Ag+)c(CrO42-)=1×10-12;Ksp(AgCl)=c(Ag+)c(Cl-)=1.8×10-10,以0.01mol/L AgNO3溶液滴定20mL0.01mol/L KCl和0.01mol/L的K2CrO4的混合溶液,c(CrO42-)=0.01mol/L,得到c(Ag+)=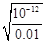 =10-5mol/L,0.01mol/L KCl溶液中,c(Cl-)=0.01mol/L;依据溶度积计算得到:c(Ag+)=2×10?10÷0.01=2×10-8mol/L,所以先析出氯化银沉淀,正确;D、则S(AgCl)=
=10-5mol/L,0.01mol/L KCl溶液中,c(Cl-)=0.01mol/L;依据溶度积计算得到:c(Ag+)=2×10?10÷0.01=2×10-8mol/L,所以先析出氯化银沉淀,正确;D、则S(AgCl)=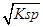 =
=
=1.41×10-5,而S(Ag2CrO4)=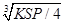 =3/2
=3/2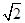 ×10-4,所以在t℃时,AgCl的溶解度小于Ag2CrO4,错误。
×10-4,所以在t℃时,AgCl的溶解度小于Ag2CrO4,错误。
考点:本题考查沉淀溶解平衡。


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:计算题
I.(1)在一密闭的2L的容器里充入8mol SO2和4mol 18O2,在一定条件下开始反应:2SO2(g)+O2(g) 2SO3(g),2min末测得容器中有7.2mol SO2。试回答:
2SO3(g),2min末测得容器中有7.2mol SO2。试回答:
① 反应后18O原子存在于哪些物质中 ;
② 2min末SO3的浓度________________________;
③ 用O2的浓度变化表示该时间段内的化学反应速率_______________________。
II.某化学反应2A (g) B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 3 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
 B(g)+D(g)是一个吸热反应,那么实验3与实验1相比,在相同体积时___________吸收的热量多,理由是___________________________________________。
B(g)+D(g)是一个吸热反应,那么实验3与实验1相比,在相同体积时___________吸收的热量多,理由是___________________________________________。查看答案和解析>>
科目:高中化学 来源: 题型:实验题
下表是稀硫酸与某金属反应的实验数据:
| 实验 序号 | 金属质 量/g | 金属 状态 | c(H2SO4)/ (mol·L-1) | V(H2SO4) /mL | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉 末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉 末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
下图为制取乙酸乙酯的实验装置图。回答下列问题: 
(1)揭示实验原理
①乙酸与乙醇在催化剂存在的条件下加热可以发生反应生成乙酸乙酯。请用氧同位素示踪法写出乙酸与乙醇发生酯化反应的化学方程式______________________。
②能否用氢同位素示踪法揭示酯化反应原理? _______(选填“能”或“不能”),原因是___________________。
(2)反应温度确定:
合成乙酸乙酯的反应为放热反应。实验表明,反应温度应控制在85℃左右为宜。回答:
实验温度不宜低于85℃左右的原因是__________________________________________;
实验温度不宜高于85℃左右的原因是__________________________________________;
(3)实验装置的比较:
利用如图装置制备乙酸乙酯,这种装置与教材装置相比较突出的优点是__________________________。
(4)酯层厚度的标示:
为更好地测定酯层厚度,可预先向饱和Na2CO3溶液中滴加1滴____试液,现象是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列事实(常温下)不能说明醋酸是弱电解质的是
| A.醋酸钠溶液pH>7 |
| B.醋酸溶液能溶解碳酸钙 |
| C.0.1mol·L-1醋酸溶液pH=2.9 |
| D.pH=1的醋酸溶液稀释100倍后pH<3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对常温下0.1 mol/L的醋酸溶液,以下说法正确的是
| A.由水电离出来的的c(H+)=1.0×10-13 mol/L |
| B.c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) |
| C.与同浓度的盐酸分别加水稀释10倍后:pH(醋酸)>pH(盐酸) |
| D.与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COO-)="0.1" mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某探究小组在某温度下测定溶液的pH时发现:0.01mol·L-1的NaOH溶液中,由水电离出的c(H+)·c(OH-)=10-22,则该小组在该温度下测得0.1mol·L-1NaOH溶液的pH应为
| A.13 | B.12 | C.11 | D.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知,25℃时有关弱酸的电离平衡常数如下: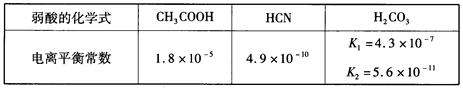
则下列有关说法正确的是( )
| A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
| B.a mol·L-1 HCN溶液与b mol·L-1NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则b一定大于a |
| C.向冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小 |
| D.等物质的量NaHCO3和Na2CO3的混合溶液中,一定存在: c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列事实能说明NH3·H2O一定是弱电解质的是
①常温下,NH3·H2O溶液能使酚酞变红; ②用NH3·H2O溶液做导电性实验,灯泡很暗;
③常温下,0.1mol / L氯化铵溶液的pH约为5
④常温下,体积相同且pH相同的NH3·H2O溶液和NaOH溶液,与相同浓度的HCl溶液中和时,消耗HCl溶液的体积:前者>后者
| A.①②③④ | B.②③④ | C.③④ | D.②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com