
| △ |
| t/min | 0 | 5 | 10 |
| AO/mol?Lˉ1 | 1.00 | 0.65 | 0.50 |
| H2/mol?Lˉ1 | 2.00 | 1.00 | |
| AH3OH/mol?Lˉ1 | 0.00 | 0.35 | 0.50 |
 ,
, ;
;| 3 |
| 12 |
| 4 |
| 32 |
| 0.7mol/L |
| 5min |
| 0.5 |
| 0.5×12 |


科目:高中化学 来源: 题型:
| A | CH3CH3+Cl2
CH2=CH2+HCl→CH3CH2Cl | 均为取代反应 | ||
| B | 明矾用于净水 碳酸钠溶液显碱性 | 均发生了水解反应 | ||
| C | Cl2+2Br?=2Cl?+Br2 Zn+Cu2+=Zn2++Cu | 均为单质被还原的置换反应 | ||
| D | 2Na2O2+2H2O=4NaOH+O2↑ Cl2+H2O=HCl+HClO | 均为水作还原剂的氧化还原反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 纯碱、烧碱等是重要的化工原料.
纯碱、烧碱等是重要的化工原料.| 实验操作 | 实验现象 | 结论 |
| (1)取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | ||
| (2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
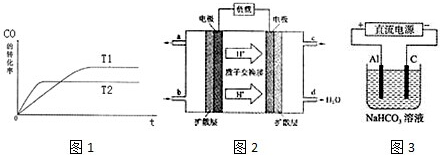
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com