
下图是实验室干馏煤的装置图,回答下列问题:
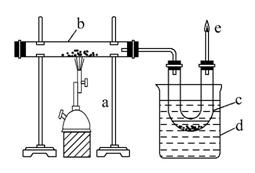
(1)指出图中仪器名称:
c ,d 。
(2)仪器d的作用是 ,
c中液体有 和 ,其中无机物里溶有 ,可用 检验出来。有机物可以通过 的方法使其中的重要成分分离出来。
(3)e处点燃的气体主要成分有 ,
火焰的颜色 。
科目:高中化学 来源: 题型:
新型高效絮凝剂Fe(OH)SO4(碱式硫酸铁)常用于污水处理,在医疗上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝等)生产碱式硫酸铁的工艺流程如下所示:
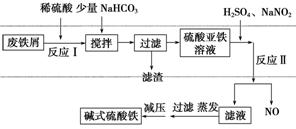
部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
请回答下列问题:
(1)加入少量NaHCO3的目的是调节溶液的pH,除去Al3+,①pH的范围__________,②写出可能发生的离子方程式:________________。
(2)在实际生产中,反应Ⅱ中常同时通入O2,以减少NaNO2的用量,O2与NaNO2在反应中均作________。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+可部分水解生成Fe2(OH)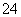 ,该水解反应的离子方程式为________________________________________________________________________。
,该水解反应的离子方程式为________________________________________________________________________。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO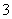 。为检验所得的产品中是否含有Fe2+,应使用的试剂为________(填序号)。
。为检验所得的产品中是否含有Fe2+,应使用的试剂为________(填序号)。
a.氯水 b.KSCN溶液
c.NaOH溶液 d.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应2AB(g) C(g)+ 3D (g)在高温下能自发进行,其逆反应在低温下能自发进行,
C(g)+ 3D (g)在高温下能自发进行,其逆反应在低温下能自发进行,
则该反应的Δ H、Δ
H、Δ S应为
S应为
A.ΔH <0,ΔS>0 B.ΔH <0,ΔS<0 C.ΔH >0,ΔS> 0 D.ΔH >0,ΔS<0
0 D.ΔH >0,ΔS<0
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界 没有热量交换) 密闭容器I、II、III,在I中充入1 mol CO和1 mol H2
没有热量交换) 密闭容器I、II、III,在I中充入1 mol CO和1 mol H2 O,在II中充入1 mol CO2 和1 mol H2,在III中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡
O,在II中充入1 mol CO2 和1 mol H2,在III中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡 时,下列说法正确的是( )
时,下列说法正确的是( )
A.容器I、II中正反应速率相同
B.容器I 、III中反应的平衡常数相同
、III中反应的平衡常数相同
C.容器I中CO 的物质的量比容器II中 的少
的少
D.容器I中CO 的转化率与容器II中CO2 的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.石油分馏得到的产物是纯净物
B.石油裂解的目的是得到更多的汽油
C.石油裂化主要是得到乙烯等气态烃
D.石油分馏能得到不同沸点范围的产物
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在资源利用、环境保护等与社会可持续发展密切相关的领域发挥着积极作用。下列做法与社会可持续发展理念相违背的是 ( )
A.改进汽车尾气净化技术,减少大气污染物的排放
B.开发利用可再生能源,减少化石燃料的使用
C.研发可降解高分子材料,减少“白色污染”
D.加速开采矿物资源,促进地方经济发展
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.煤的气化和液化是使煤变成清洁能源的有效途径
B.煤的干馏过程属于物理变化,通过干馏可以得到焦炉气、煤焦油、焦炭等产品
C.工业上大量燃烧含硫燃料是形成“酸雨”的主要原因
D.煤是由非常复杂的无机物和有机物组成的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
亚氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体:按下图装置进行制取。
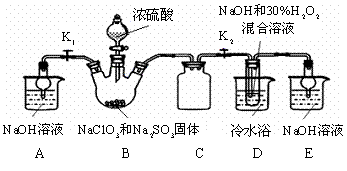 |
已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要 (填仪器名称);
(2)装置C的作用是 ;
(3)装置B内生成的ClO2气体与装置D中混合溶液反应生成NaClO2,生成NaClO2的反应方程式为 。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是 ;
(5)反应后,经以下步骤可从装置D的溶液获得NaClO2晶体。请补充完整操作iii。
i.55℃蒸发结晶; ii.趁热过滤; iii. ; iv.低于60℃干燥,得到成品。
实验Ⅱ:样品杂质分析与纯度测定
(6)上述实验制得的NaClO2晶体中含少量Na2SO4。产生Na2SO4最可能的原因是 ;
a. B中有SO2气体产生,并有部分进入D装置内
b. B中浓硫酸挥发进入D中与NaOH中和
c. B中的硫酸钠进入到D装置内
NaClO2中含少量Na2SO4可用重结晶的方法提纯。下列有关物质的提纯方案不正确的
是
| 被提纯的物质 [括号内物质是杂质] | 除杂试剂 | 除杂方法 | |
| a | CO(g) [CO2(g)] | NaOH溶液、 浓H2SO4 | 洗气 |
| b | NH4Cl(aq) [Fe3+(aq)] | NaOH溶液 | 过滤 |
| c | Cl2(g) [HCl(g)] | 饱和食盐水、浓H2SO4 | 洗气 |
| d | Na2CO3(s) [NaHCO3(s)] | — | 加热 |
(7)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。
取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是 ;
②所称取的样品中NaClO2的物质的量为 (用含c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知
Fe(s)+CO2(g) FeO(s)+CO(g) K1①
FeO(s)+CO(g) K1①
Fe(s)+H2O(g) FeO(s)+H2(g) K2②
FeO(s)+H2(g) K2②
H2(g)+CO2(g)  H2O(g)+CO(g) K3③
H2O(g)+CO(g) K3③
又已知不同温度下,K1、K2值如下:
| 温度/ ℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |
(1)若500 ℃时进行反应①,CO2起始浓度为2 mol·L-1,2分钟后建立平衡,则CO2转化率为________,用CO表示的速率为_____________________________。
(2)900 ℃进行反应③,其平衡常数K3为________(求具体数值),焓变ΔH________0(填“>”“=”或“<”),若已知该反应仅在高温时正反应自发,则ΔS________0(填“>”“=”或“<”)。
(3)下列图像符合反应②的是________(填序号)(图中v是速率,φ为混合物中H2的体积百分量)。
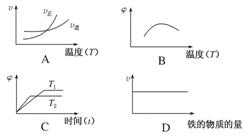
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com