
(16分)二甲醚是重要的有机中间体,利用二氧化碳加氢合成二甲醚能变废为宝,且可替代汽油作为新型清洁燃料。
(1)常温常压下,二氧化碳加氢可选择性生成二甲醚或一氧化碳:
①CO2 (g)+3H2(g)=CH3OH(l)+H2O(l) △H1 =-55.7 kJ/mol
②2CH3OH(l) = CH3OCH3(g)+H2O (l) △H2 =-23.4 kJ/mol
③CO2 (g)+3H2(g) =CO(g) + H2O (l) △H 3>0
则CO2(g)加氢转化为CH3OCH3(g)和H2O (l)的热化学方程式是___________________________________________________。
(2)合成二甲醚往往选用硅铝混合物作催化剂,硅铝比例不同,生成二甲醚或一氧化碳的物质的量分数不同。下图是硅铝比与产物选择性图:
反应③的平衡常数表达式为 ,图中A点和B点的平衡常数比较:KA______KB(填“>、=、<”)。根据以上两条曲线,写出其中一条变化规律: ___________________。
(3)在280oC时,向一个2L的密闭容器中加入等量2mol二氧化碳和氢气, A点二甲醚的浓度为0.15 mol·L-1,计算在A点二氧化碳的转化率,要求写出计算过程。
(4)二甲醚逐渐发展为替代汽油的清洁燃料,在二甲醚燃料电池中,二甲醚通入______极,碱性条件下,该电极反应式是 。
(1)2CO2(g)+6H2(g) = CH3OCH3(g)+3 H2O(l) △H =-134.8kJ/mol (3分)
(2)K=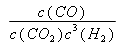 (2分) “="”" (2分)
(2分) “="”" (2分)
a.温度越高,二甲醚的选择性越大;b.低温时硅铝比对二甲醚的选择性影响不大,高温时随着硅铝比增大,二甲醚的选择性先增大后减小。(其它正确答案均可得分,2分)
(3)起始状态c(H2)=c(CO2)=2mol/2L=1mol/L
2CO2+6H2=CH3OCH3+ 3H2O
c(起始) 1.00mol/L 1.00mol/L 0 0
c(转化) 0.30mol/L 0.90mol/L 0.15mol/L 0.45mol/L
c(平衡) 0.70mol/L 0.10mol/L 0.15mol/L 0.45mol/L
CO2的转化率= (2分,答案正确且有过程均给2分)
(2分,答案正确且有过程均给2分)
(4)负 (2分) CH3OCH3+16OH--12e-═2CO32-+11H2O(3分,配平错误只扣1分)
解析试题分析:(1)CO2(g)加氢转化为CH3OCH3(g)和H2O (l)的热学方程式2CO2(g)+6H2(g)= CH3OCH3(g)+3H2O(l),根据盖斯定律,分析反应①、②及该反应的关系可知,将①式乘以2并加上②式可得该反应,故△H =2△H1+△H2=-23.4 kJ/mol ×2+(-55.7 kJ/mol)=-134.8kJ/mol;(2)反应③中的生成物水是纯液体,浓度为常数,故平衡常数表达式为: K=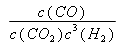 ;平衡常数只受温度影响,图中280oC下的A点和B点的平衡常数相等;从图中两条曲线的变化趋势及对比情况可以看出:230oC的曲线变化相对平缓,280oC的曲线变化程度较大且先升后降,280oC二甲醚物质的量分数较大,温度升高,二甲醚的物质的量浓度的变化受影响的程度也有所改变等,故可以概括为:a.温度越高,二甲醚的选择性越大;b.低温时硅铝比对二甲醚的选择性影响不大,高温时随着硅铝比增大,二甲醚的选择性先增大后减小;等等。
;平衡常数只受温度影响,图中280oC下的A点和B点的平衡常数相等;从图中两条曲线的变化趋势及对比情况可以看出:230oC的曲线变化相对平缓,280oC的曲线变化程度较大且先升后降,280oC二甲醚物质的量分数较大,温度升高,二甲醚的物质的量浓度的变化受影响的程度也有所改变等,故可以概括为:a.温度越高,二甲醚的选择性越大;b.低温时硅铝比对二甲醚的选择性影响不大,高温时随着硅铝比增大,二甲醚的选择性先增大后减小;等等。
(3)依题意可知,起始状态c(H2)=c(CO2)=2mol/2L=1mol/L
2CO2 + 6H2 = CH3OCH3 + 3 H2O
c(起始) 1.00mol/L 1.00mol/L 0 0
c(转化) 0.30mol/L 0.90mol/L 0.15mol/L 0.45mol/L
c(平衡) 0.70mol/L 0.10mol/L 0.15mol/L 0.45mol/L
CO2的转化率=
(4)在二甲醚燃料电池中,二甲醚作为燃料,氧气作为氧化剂,故二甲醚应通入负极,碱性条件下,燃料电池中负极上燃料失电子发生氧化反应,该电极反应式为: CH3OCH3+16OH--12e-═2CO32-+11H2O。
考点:考查热化学方程式、化学平衡常数的应用及燃料电池电极反应式。


科目:高中化学 来源: 题型:单选题
下列叙述错误的是
| A.光导纤维的主要成分是硅酸盐 |
| B.过氧化钠可用于呼吸面具作为氧气的来源 |
| C.氧化铁常用作红色油漆和涂料 |
| D.常温下可用铁制或铝制容器盛装浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(10分)某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol· L-1盐酸、0.55mol·L-1NaOH溶液,尚缺少的实验玻璃用品是 、 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒? (填“能”或“否”)。
(3)他们记录的实验数据如下:已知:Q=Cm(t2 -t1),反应后溶液的比热容C为4.18kJ·℃-1· kg-1,各物质的密度均为1g·cm-3。①计算完成下表。(保留小数点后一位)
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:
(4)若用KOH代替NaOH,对测定结果 (填“有”或“无”)影响;若用醋酸代替HCl做实验,测定所得的中和热的数值将 (填“变大”或“变小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某一反应物在一定条件下的平衡转化率为25.3%,当使用了催化剂时,其转化率为
| A.大于25.3% | B.小于25.3% | C.等于25.3% | D.不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中正确的是
| A.凡是放热反应都是自发的,凡是吸热反应都是非自发的 |
| B.自发反应一定是熵增大的反应,非自发反应一定是熵减小的反应 |
| C.自发反应在恰当条件下才能实现 |
| D.自发反应在任何条件下都能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有常温时pH=1的某强酸溶液10 mL,下列操作能使溶液的pH变成2的是
| A.加水稀释成100 mL。 |
| B.加入10 mL的水进行稀释。 |
| C.加入10 mL 0.01 mol/L的NaOH溶液。 |
| D.加入10 mL 0.01 mol/L的HCl溶液。 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学家认为石油、煤作为能源使用时,燃烧了“未来的原始材料”。下列对上述观点理解正确的是
| A.大力提倡使用廉价化石燃料作为能源 |
| B.化石燃料属于可再生能源,不影响可持续发展 |
| C.应更多地利用石油和煤生产基本化工原料 |
| D.研发新型催化剂,提高石油和煤中各组分的燃烧热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com