
【题目】合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。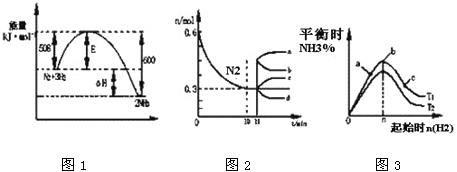
下列说法正确的是
A. 该反应为自发反应,由图1可得加入适当的催化剂,E和△H都减小
B. 图2中0~10min内该反应的平均速率v(H2)=0.045mol·L-1·min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d
C. 图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点
D. 图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2
【答案】B
【解析】试题分析:A.根据图示可知反应物的能量高于生成物,所以反应发生时会放出热量,由于反应的混乱程度减小,所以ΔG=ΔH-TΔS<0,反应可自发进行,但是加入催化剂时E减小而△H不变,错误;B.图2中0~10min内该反应的平均速率v(N2)="(0.6mol-0.3mol)÷2L÷10min" =0.015mol·L-1·min-1,由于v(H2): v(N2)=3:1,所以v(H2)=0.045mol·L-1·min-1,从11min起其它条件不变,压缩容器的体积为1L,即增大压强,N2的浓度是原来的2倍,由于增大压强,平衡正向移动,所以c(N2)又逐渐减小,最终达到平衡,因此n(N2)的变化曲线为d,正确;C.在其它条件不变时,开始时加入的氢气越多,则平衡正向移动的趋势就越大,反应达到平衡时反应物N2的转化率就越高,所以图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是c点,错误;D.由于该反应的正反应是放热反应,在其它条件不变时,升高温度,平衡向吸热的逆反应方向移动,氨气的平衡含量降低,平衡常数减小。图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1<T2,K1>K2,错误。


科目:高中化学 来源: 题型:
【题目】向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s) ![]() yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:

(1)用A的浓度变化表示该反应在0~10 min内的平均反应速率v(A)=______________________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是______________________;第16min引起曲线变化的反应条件可能是________________________。
①减压 ②增大A的浓度 ③增大C的量 ④升温⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 标准状况下,6. 72 L NO2与水反应转移的电子数为0.1NA
B. 1 L 0.1 mol/L的碳酸钠溶液中的阴离子总数等于0.1NA
C. 1 mol Cl2与足量 Fe反应转移电子数一定为3NA
D. 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 1.8 g D2O含有NA个中子
B. 标准状况下,22.4 L己烷中共价键数目为19NA
C. 5.35 g NH4Cl固体中含有N—H键的个数为0.4NA
D. 常温下将0.1 mol Fe投入足量的浓硝酸中,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在①蛋白质 ②油脂 ③葡萄糖 ④纤维素四种物质中,不能水解的是____(填序号),在人体中不能直接被消化吸收的是_________(填序号),蛋白质水解后生成_________(填名称,下同),油脂水解后生成___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应∶2NO2![]() 2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2n molNO2;②单位时间内生成n molO2 的同时,生成2n mol NO;③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态;④混合气体的颜色不再改变的状态;⑤混合气体的密度不再改变的状态;⑥ 混合气体的平均相对分子质量不再改变的状态
A. ①④⑥ B. ②③⑤ C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列两种试剂不能做喷泉实验的是( )
A. NO2 水 B. CO2 4 molL-1NaOH溶液
C. Cl2 饱和NaCl溶液 D. NH3 1 molL-1盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组的同学们利用如图装置,探究不同条件对铁与酸反应速率的影响. 
请回答下列问题.
(1)铁与稀硫酸反应的离子方程式是 .
(2)适当升高烧瓶内液体的温度,产生气泡的速率将(填“加快、”“减慢”或“不变”),由此得出的结论是 .
(3)将稀硫酸换为浓硫酸,可观察到 , 原因是 .
(4)向烧瓶中滴入几滴CuSO4溶液,产生气泡的速率明显加快.这是什么原因? 甲同学:CuSO4溶液中的Cu2+对铁与稀硫酸的反应起了催化作用.
乙同学:CuSO4与Fe反应生成了Cu,从而Fe、Cu、稀硫酸构成了原电池,使反应速率加快.
你同意的观点,欲证明此观点,可另取一套上图装置,向烧瓶中直接加入少量 , 观察现象.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com