
【题目】目前我国许多城市和地区定期公布空气质量报告,在空气质量报告中,一般不涉及( )
A.SO2
B.NO2
C.CO2
D.可吸入颗粒物
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I﹣═2Fe2++I2
B.NH4HCO3溶液中加入过量的NaOH溶液并加热:HCO3﹣+OH+![]() CO32﹣+H2O
CO32﹣+H2O
C.稀硝酸除银镜:Ag+2H++NO3﹣═Ag++NO↑+H2O
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2═2Fe3++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )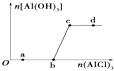
A.a点对应的溶液中:Na+、Fe3+、SO42﹣、HCO3﹣
B.b点对应的溶液中:Na+、S2﹣、SO42﹣、Cl﹣
C.c点对应的溶液中:K+、Ag+、Ca2+、NO3﹣
D.d点对应的溶液中:K+、NH4+、CO32﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I﹣═2Fe2++I2
B.NH4HCO3溶液中加入过量的NaOH溶液并加热:HCO3﹣+OH+![]() CO32﹣+H2O
CO32﹣+H2O
C.稀硝酸除银镜:Ag+2H++NO3﹣═Ag++NO↑+H2O
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2═2Fe3++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积可变的密闭容器中发生反应:CO(g) + H2O(g) CO 2 (g) + H2O(g)(正反应为放热反应),改变下列条件,不能使ν正 增大的是
A. 升高温度B. 恒容充He
C. 缩小容器体积D. 恒容时充入更多的H2O(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫原子的质量是a g,12C原子的质量是b g,若NA只表示阿伏伽德罗常数的数值,则下列说法中正确的是( )
①该硫原子的相对原子质量为 ![]() ②m g该硫原子的物质的量为
②m g该硫原子的物质的量为 ![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列排列顺序正确的是
①热稳定性:H2O>HF>H2S ②离子半径:O2->Na+>Mg2+
③酸性:H3PO4>H2SO4>HClO4 ④结合质子能力:OH->CH3COO->Cl-
A. ①③ B. ②④ C. ①④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、O、Na、Mg、S、Br是常见的六种元素.
(1)Br位于元素周期表第周期第族;Na和O形成1:1的化合物的电子式: . 该物质含有的化学键为: .
(2)用“>”或“<”填空:
稳定性 | 粒子半径 | 熔点 | 键的极性 |
NH3H2O | O2﹣Mg2+ | SO3 | H﹣O |
(3)已知多硫化钠一溴储能电池是一种二次电池,结构如图.电池总反应为:2Na2S3+2NaBr ![]() 3Na2S2+Br2①放电时Na+向极迁移(填“a或b,”).
3Na2S2+Br2①放电时Na+向极迁移(填“a或b,”).
②放电时负极的电极反应式为:
(4)已知N4为正四面体结构,N﹣N键能为167kJmol﹣1 , N≡N键能为942kJmol﹣1 . 写出N4(g)转化为N2(g)的热化学方程式 . 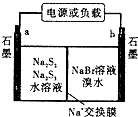
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质.请你参与研究并回答下列问题: 
(1)甲同学完成了Fe、Cu分别与S、Cl2反应的实验,下列物质中不可能为甲同学实验得到的生成物是
A.FeCl3
B.FeCl2
C.CuCl2
D.FeS
(2)乙同学为验证Fe能和热的浓HNO3反应,设计了如图所示的实验装置,请说出装置B的作用: . 开始加热前(填“有”或“无”)明显现象.
(3)当乙同学实验结束时,铁完全溶解,试管液面上方为无色气体,试管上部为红棕色气体,此时丙同学用所得的溶液进行如下实验和探究:
①在所得的溶液中加入一小块Cu片,结果Cu片先逐渐溶解,并伴随其他现象,反应一段时间后不再溶解.丙同学依据反应现象得出Cu片溶解的原因可能是和过量的HNO3发生反应.他依据的反应现象是;该反应的离子方程式为 . 你认为Cu片溶解是否还有另一原因,若有请用化学方程式表示其理由:(若无此空不填)
②请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe2+但不含有Fe3+ . 说明具体的操作和实验现象 .
③丙同学实验结束后加水稀释后得到溶液500mL,假设实验全过程硝酸只被还原成NO和NO2共0.02mol并测得溶液中Fe2+和Cu2+浓度均为0.02mol/L,则NO3﹣的物质的量浓度为mol/L.生成NO气体的体积为L(标准状况).
(4)本次探究实验用掉密度为1.5gcm﹣3质量分数为95%的浓硝酸3mL,超出实际参加反应的量其原因有(写出两点):①② .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com