
【题目】250℃和1.01×105Pa时,反应 2N2O5(g)=4NO2(g)+O2(g) △H=+56.76kJ/mol,自发进行的原因( )
A. 是吸热反应 B. 是放热反应
C. 是熵减少的反应 D. 熵增大效应大于焓增大的效应
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E是原子序数依次增大的五种短周期元素,A与C同主族,A与B、A与E形成共价化合物,A与B形成的最简单化合物的水溶液呈碱性,E的最高正化合价与最低负化合价的代数和为6,D是同周期中简单离子半径最小的元素。
(1)五种元素中,E在元素周期表中的位置是______,画出C的原子结构示意图:________。
(2)B的气态氢化物与其最高价氧化物对应的水化物反应生成的化合物中存在的化学键类型为________。
(3)C的最高价氧化物对应的水化物与D的最高价氧化物反应的化学方程式为_____________________________。
(4)已知X、Y、Z三种物质中均含有上述元素中的某一种元素,它们之间存在如图所示的转化关系:
![]()
①X、Y、Z均含有同一种金属元素,若W固体俗称干冰,则反应Y―→Z的离子方程式为________________________;若W是强碱,且Y是白色难溶固体,则反应Y→Z的离子方程式为________________________________。
②X、Y、Z是均含有同一种非金属元素的化合物,W是一种常见金属单质,且上述转化均在常温条件下完成,则反应Z―→Y的离子方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏伽德罗常数为6.02×1023mol﹣1 . 关于1mol H2O的叙述正确的是( )
A.含有1mol H2
B.含有6.02×1023个水分子
C.质量为18 g/mol
D.在标准状况下的体积为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图是石油分馏塔的示意图。a、b、c三种馏分中________

A.a的沸点最高
B.b的熔点最低
C.c的平均相对分子质量最大
D.每一种馏分都是纯净物
Ⅱ.裂化汽油中除含有C6~C11的烷烃外,还含有C5~C11的烯烃及甲苯、二甲苯等苯的同系物。已知甲苯、二甲苯能使酸性KMnO4溶液褪色。要用化学方法检验某裂化汽油样品中含有烯烃及苯的同系物,实验步骤为:
(1)先逐滴加入________,振荡,如果看到______,则证明有________存在。
(2)继续逐滴加入________至________为止,静置,用分液漏斗分出________(填“上”或“下”)层的裂化汽油样品,再加入________振荡,如果看到________,则证明裂化汽油中有________存在。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中粒子的物质的量浓度关系正确的是( )
A. 0.1mol/|LCH3COONa 与0.lmol/LHCl 溶液等体积混合: c(Na+)=c(Cl-)>c(OH-)>cCH3COO-)
B. 0.lmol/LNH4Cl与0.lmol/L 氨水等体积浪合(pH>7): c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
C. 0.1mol/LNa2CO3与0.lmol/LNaHCO3溶液等体积混合:2/3c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D. 0.1mol/LNa2C2O4与0.lmol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,甲、乙两容器分别盛有甲烷气体和氨气,已知它们所含原子个数相同,则甲、乙两容器的体积比为( )
A.4:5
B.5:4
C.4:3
D.1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单晶硅是信息产业中重要的基础材料。工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4、和CO,SiCl4经提纯后用氢气还原得高纯硅。以下是实验室制备SiCl4的装置示意图。

实验过程中,石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4、AlCl3、FeCl3遇水均易水解,有关物质的物理常数见下表:
物质 | SiCl4 | AlCl3 | FeCl3 |
沸点/℃ | 57.7 | — | 315 |
熔点/℃ | -70.0 | — | — |
升华温度/℃ | — | 180 | 300 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式: ,装置D的硬质玻璃管中发生主要反应的化学方程式是_____________________________。
(2)装置C中的试剂是 ;D、E间导管短且粗的原因是________________________________。
(3)G中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和SO![]() 。请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2的影响)。
。请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2的影响)。
【提出假设】假设1:只有SO![]() ;假设2:既无SO
;假设2:既无SO![]() 也无ClO-;假设3: 。
也无ClO-;假设3: 。
【设计方案,进行实验】可供选择的试剂有:3 mol·L-1 H2SO4溶液、1 mol·L-1 NaOH溶液、0.01 mol·L-1 KMnO4溶液、溴水、淀粉KI溶液、品红溶液等。
取少量吸收液于试管中,滴加3 mol·L-1 H2SO4溶液至溶液呈酸性,然后将所得溶液分置于a、b、c三支试管中,分别进行下列实验。请完成下表:
序号 | 操作 | 可能出现的现象 | 结论 |
① | 向a试中滴加几滴 | 若溶液褪色 | 则假设1成立 |
若溶液不褪色 | 则假设2或3成立 | ||
② | 向b试管中滴加几滴 | 若溶液褪色 | 则假设1或3成立 |
若溶液不褪色 | 则假设2成立 | ||
③ | 向c试管中滴加几滴 | 则假设3成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,5种银盐的溶度积常数(Ksp)分别是:
AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
下列说法正确的是
A. 氯化银、溴化银和碘化银的溶解度依次增大
B. 将硫酸银溶解于水后,向其中加入少量硫化钠溶液,不能得到黑色沉淀
C. 在5mL1.8×10-5mol/L的NaCl溶液中,加入1滴(1mL约20滴)1.0×10-3 mol/L的AgNO3溶液,能观察到白色沉淀
D. 将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,可以有少量白色固体生成窗体顶端
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学探究铜与硝酸的反应。
(1)用浓硝酸和水按照不同体积比配成不同浓度的硝酸,各取10 mL硝酸分别与铜片反应,实验记录如下:
序号 | 浓硝酸与水 的体积比 | 实验现象 |
Ⅰ | 1∶1 | 反应速率快,溶液很快变成蓝色,铜丝表面有大量气泡冒出,气体呈红棕色 |
Ⅱ | 1∶3 | 反应速率较快,溶液变成蓝色,铜丝表面有大量气泡冒出,气体无色 |
Ⅲ | 1∶5 | 反应速率慢,微热后速率加快,溶液变成蓝色,铜丝表面有气泡冒出,气体无色 |
①铜与稀硝酸反应的离子方程式为______________;若生成标准状况下0.56 L NO气体,反应中被还原的HNO3的质量为________g(小数点后保留两位有效数字)。
②依据上表,制备NO气体最适宜的是实验Ⅱ,理由是_______________________。
(2)为防止有毒气体逸散造成空气污染,该小组同学改进实验装置,如图所示(夹持仪器略去)。
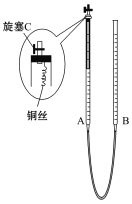
用该装置进行铜与稀硝酸的反应并验证产生NO气体的性质,实验步骤如下:
Ⅰ.安装好装置后,检查装置气密性。
Ⅱ.打开旋塞C,从B管上端加入所选浓度的硝酸,至铜丝下沿(不接触铜丝)。
Ⅲ.向上移动B管,使A管液面上升至与橡胶塞恰好接触,关闭旋塞C,反应开始。
Ⅳ.当液面重新下降至与铜丝脱离接触时,反应停止。
Ⅴ.打开旋塞C,移动B管,使A中迅速进入少量空气,关闭旋塞C,观察现象。
……
①步骤Ⅰ中检查装置气密性的操作是:关闭旋塞C,从B管上端加入水,若观察到____________________,说明装置的气密性良好。
②步骤Ⅲ操作的目的是_________________________________。
③为使A管内的NO气体完全被溶液吸收,可进一步采取的操作是__________________,能确定NO完全被溶液吸收的现象是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com