
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表。下列说法错误的是

A.反应达到平衡时,X的转化率为50%
B.改变温度可以改变此反应的平衡常数
C.反应可表示为X+3Y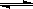 2Z,其平衡常数为1600
2Z,其平衡常数为1600
D.增大压强使平衡向生成Z的方向移动,平衡常数增大
科目:高中化学 来源: 题型:
下列反应中,反应前后元素的化合价没有变化的是 ( )
A.CO2+C 2CO B.SO2+H2O
2CO B.SO2+H2O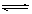 H2SO3
H2SO3
C.2NaOH+Cl2====NaCl+NaClO+H2O D.2CO+O2 2CO2
2CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验设计能完成或实验结论合理的是( )
A.证明一瓶红棕色气体是溴蒸气还是二氧化氮,可以用湿润的碘化钾—淀粉试纸检验,观察试纸颜色的变化
B.测氯水的pH,用玻璃棒蘸取氯水点在干燥的pH试纸上,待其变色后和标准比色卡对照
C.铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO4溶液中不反应,说明铁钉表面形成了一层致密稳定的氧化膜
D.向某溶液中加入稀盐酸,能产生使澄清石灰水变浑浊的气体,说明该溶液中一定含有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示某气态单质A及其化合物之间的转化关系 (某些产物和反应条件已略去)。
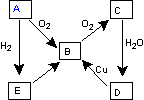 (1)A单质的电子式
(1)A单质的电子式
(2)写出E生成B的化学方程式:
。
(3)①写出由D生成B的离子方程式 。
②常温下D和E恰好完全反应后溶液的pH ______7(填“大于”、“小于”或“等于”),理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,反应A2(g)+B2(g)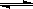 2AB(g)达到平衡的标志是(NA代表阿伏加德
2AB(g)达到平衡的标志是(NA代表阿伏加德
罗常数)
A.单位时间生成NA的A2同时生成NA的AB
B.容器内的总压不随时间变化
C.单位时间生成2NA的AB同时生成NA的B2
D.单位时间生成NA的A2同时生成NA的B2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某反应在不同条件下的反应历程可以表
示成右图,E1表示反应物分子变成原子所吸收的热量,
E2表示这些原子重新成键形成生成物放出的热量,请回
答下列问题:
(1)据图判断该反应是 ▲ (填“吸”或“放”)热反应,如该反应可逆,则其达到平衡后,其他条件不变,升高温度,反应物的转化率 ▲ (填“增大”、“减小”或“不变”),其中B历程表明此反应改变的条件为 ▲ (填字母)。
A.增大反应物的浓度 B.降低温度 C.增大压强 D.使用催化剂
(2)下表给出了一些化学键的键能:
| 化学键 | H—H | Cl—Cl | O=O | O—H | H—Cl |
| 键能(kJ·mol-1) | 436 | 247 | x | 463 | 431 |
①若图中表示反应H2(g) +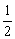 O2(g)=H2O(g) ΔH= - 241.8 kJ·mol-1,则x= ▲ kJ·mol-1(保留一位小数)。
O2(g)=H2O(g) ΔH= - 241.8 kJ·mol-1,则x= ▲ kJ·mol-1(保留一位小数)。
②催化剂、加热条件下可用氧气与氯化氢气体反应置换出氯气,同时生成另一种气态化合物,利用上表数据写出该热化学方程式 ▲ ,当该反应中有1 mol电子发生转移时,图像中历程A的E1= ▲ kJ(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某KCl、MgCl2、Mg(NO3)2形成的混合中, c(K+)=0.20mol/L, c(Mg2+)=0.25mol/L,
c(Cl-)=0.20mol/L, 则c(NO3-)为
A. 0.15mol/L B. 0.10mol/L C. 0.25mol/L D. 0.50mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
)(1)常温下,将0.2 mol/L HCl溶液与0.2 mol/L氨水等体积混合(忽略混合后溶液体积的变化),测得混合后溶液的pH=6,试回答以下问题:
(1)混合后溶液呈酸性的原因是(用离子方程式回答) 。
(2)混合后溶液中由水电离出的c(OH-)为
(3)常温下,将0.2 mol·L-1的盐酸与 0.2mol·L-1的氨水混合,若所得的混合溶液中的pH=7,下列关系正确的是
A、[Cl-]>[NH4+]> [H+] > [OH-] B、[NH4+]>[Cl-]>[OH-]>[H+]
C、[Cl-]=[NH4+]>[H+]=[OH-] D、[NH4+]>[Cl-]>[H+]>[OH-]
(4)由电离常数可知酸性强弱: CH3COOH>H2CO3>HCO3-,则浓度相同的下列溶液碱性由强到弱顺序为: (填序号)
①CH3COONa ② NaHCO3 ③ Na2CO3
(5)将氯化铁溶液蒸干、灼烧,最后得到的固体是 。
(6)Cu(OH)2(s) 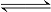 Cu2+(aq)+2OH-(aq),在常温下Ksp( Cu(OH)2)=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol•L-1的CuSO4溶液中加入NaOH溶液,调整pH最小到 。
Cu2+(aq)+2OH-(aq),在常温下Ksp( Cu(OH)2)=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol•L-1的CuSO4溶液中加入NaOH溶液,调整pH最小到 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com