
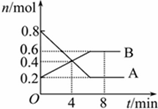
 某温度时,在0.5L密闭容器中某一反应的A,B气体物质随时间变化的曲线如图所示,由图中数据分析求得:
某温度时,在0.5L密闭容器中某一反应的A,B气体物质随时间变化的曲线如图所示,由图中数据分析求得:| △c |
| △t |
 2B,故答案为:3A
2B,故答案为:3A 2B;
2B;| △c |
| △t |
| ||
| 4min |
| 0.8mol-0.2mol |
| 0.8mol |
| 0.4mol |
| 0.5L |


科目:高中化学 来源: 题型:
| A、Cl2通入NaOH溶液:Cl2+OH-═Cl-+ClO-+H2O |
| B、NaHCO3溶液中加入稀HCl:CO32-+2H+═CO2↑+H2O |
| C、AlCl3溶液中加入过量稀氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| D、Cu溶于稀HNO3:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
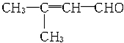 ,则该物质可能具有的化学性质为( )
,则该物质可能具有的化学性质为( )| A、①③④⑤ | B、②③④⑥ |
| C、①③⑤ | D、①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | - 4 |
| O | - 4 |
| A、+1 | B、+2 | C、+3 | D、+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+,无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+,无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
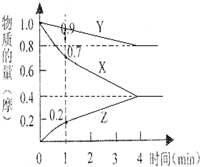 (1)某温度时,2L的密闭容器中X、Y、Z三种物质的物质的量随时间的变化如图所示.由图中数据分析,该反应的化学方程式为
(1)某温度时,2L的密闭容器中X、Y、Z三种物质的物质的量随时间的变化如图所示.由图中数据分析,该反应的化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
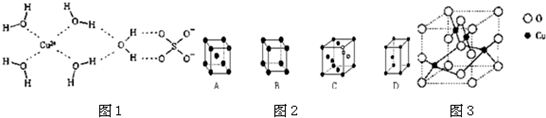
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ?mol-1) | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热某废塑料得到的产物如表:
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热某废塑料得到的产物如表:| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
| ① |
| ② |
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、焰色反应一定发生化学变化 |
| B、Na与NaCl在灼烧时火焰颜色相同 |
| C、焰色反应是物质检验的一种实验方法 |
| D、观察K2SO4的焰色应透过蓝色的钴玻璃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com