
【题目】对 N2+3H22NH3 反应,仅改变下列一个条件,就能提高活化分子的浓度从而加快正反应速率的是 ( )
A.加热
B.增大体积
C.加负催化剂
D.补充 He
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】二氧化硅有晶体和无定形两种形态,晶态二氧化硅主要存在于石英矿中.除石英外,SiO2还有磷石英和方英石等多种变体.方英石结构和金刚石相似,其结构单元如图.下列有关说法正确的是( ) 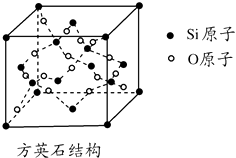
A.方英石晶体中存在着SiO4结构单元
B.1 mol Si形成2 mol Si﹣O键
C.上图所示的结构单元中实际占有18个硅原子
D.方英石晶体中,Si﹣O键之间的夹角为90°
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法中不正确的是( )
A.NO2和N2O4的混合气体中,NO2的体积分数是80%
B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L
C.该合金中铜与镁的物质的量之比是2:1
D.得到2.54g沉淀时,加入NaOH溶液的体积是600mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向MgCl2、Al2(SO4)3的混合溶液中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则原溶液中Mg2+与Al3+的物质的量之比是( )
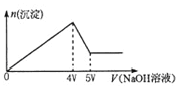
A. 1:2 B. 1:1 C. 2:3 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关硅元素的下列叙述中正确的是( )
A.硅、碳与氢氟酸都不反应
B.硅是构成矿物岩石的主要原料,其化合态硅几乎全部是硅石和硅酸盐
C.硅与碳性质都很稳定,都能以游离态存在于自然界
D.晶体硅、石墨都可作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟化钡可用于制造电机电刷、光学玻璃、光导纤维、激光发生器。以钡矿粉(主要成分为BaCO3,含有SiO2、Fe2+、Mg2+等杂质)制备氟化钡的流程如下:
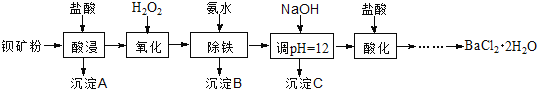
已知:常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4。
(1)滤渣A的名称为___________。
(2)滤液1加H2O2的目的是___________。
(3)加NaOH溶液调节pH=12.5,得到滤渣C的主要成分是___________(写化学式)
(4)滤液3加入盐酸酸化后再经加热浓缩____________洗涤,真空干燥等一系列操作后得到BaCl2·2H2O晶体。
(5)常温下,用BaCl2·2H2O配制成0.2 mol/L水溶液与氟化铵溶液反应,可得到氟化钡沉淀。请写出该反应的离子方程式___________。已知Ksp(BaF2)=1.84×10-7,当钡离子完全沉淀时(即钡离子浓度≤10-5 mol/L),至少需要的氟离子浓度是___________mol/L(已知![]() =1.36,计算结果保留三位有效数字)。
=1.36,计算结果保留三位有效数字)。
(6)5.0 t含80%BaCO3的钡矿粉,理论上最多能生成BaCl2·2H2O晶体___________t 。(保留2位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图表示在某溶液中滴加Ba(OH)2 溶液时,沉淀的物质的量随Ba(OH)2 的物质的量的变化关系。该溶液的成分可能是
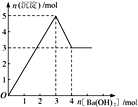
A. MgSO4 B. Al2 (SO4 )3 C. Fe2 (SO4 )3 D. NaAlO2
【答案】B
【解析】A、氢氧化镁不溶于氢氧化钡溶液,沉淀量达最大后,再加氢氧化钡溶液,沉淀量不变,A错误;B、由图可知溶解氢氧化铝需要1mol氢氧化钡,由Al(OH)3+OH-===AlO2-+2H2O可知沉淀中Al(OH)3为2mol,故Al2(SO4)3为1mol,加入3mol氢氧化钡,可以生成硫酸钡3mol,n(Al3+):n(OH-)=2mol:6mol=1:3,发生反应Al3++3OH-===Al(OH)3↓,可以得到2molAl(OH)3,沉淀为3mol+2mol=5mol,B正确;C、硫酸铁与氢氧化钡溶液反应生成氢氧化铁,氢氧化铁不溶于氢氧化钡,则沉淀量达最大后,再加氢氧化钡溶液,沉淀的量不变,与图象不一致,C错误;D、偏铝酸钠与氢氧化钡不反应,不能产生沉淀,D错误;答案选B。
点睛:本题以图象为载体考查镁铝化合物的性质,明确发生的化学反应是解答的关键,反应发生的先后顺序是学生解答中的难点,注意图象比例关系,注意氢氧化铝两性特点。
【题型】单选题
【结束】
15
【题目】如图所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和盐酸时沉淀的物质的量y mol与加入NaOH溶液和盐酸的体积x mL的关系图,根据图示判断,下列结论中不正确的是
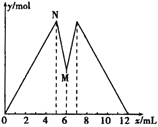
A. N点时溶液中的溶质只有NaCl
B. 原混合溶液中c (MgCl2)∶c (AlCl3)=1∶2
C. c (NaOH)=c (HCl)
D. M点之前加入的是NaOH溶液,M点之后加入的是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表。J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。

(1)M的离子结构示意图为________;元素T在周期表中位于第________族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为_____________________。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为________________________________________________________________________。
(4)L的最简单气态氢化物甲的水溶液显碱性。在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com