
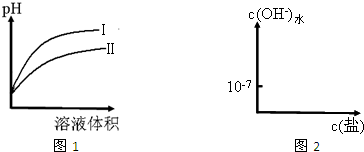
常温下,相同pH的H2SO4溶液和Al2(SO4)3溶液中,水电离出的c(H+)分别是1.0´10-amol×L-1和1.0´10-bmol×L-1,水的电离度分别是a1和a2,下列关系式正确的是( )
A.a1=a2 B.a+b>14 C.a>7,b<7 D.![]()
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
| 弱酸 | CH3COOH | H2SO3 | HCN |
| 物质的量浓度mol/L | 0.01 | 0.01 | 0.01 |
| pH | 3.4 | 2.3 | 5.6 |
 HSO3-+OH-
HSO3-+OH- HSO3-+OH-
HSO3-+OH-| c(H+) |
| c(CH3COOH) |
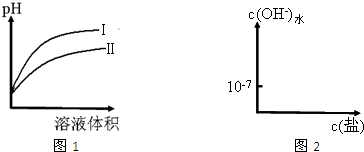
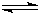 H+(aq)+CN-(aq)△H=+43.5kJ?mol-1
H+(aq)+CN-(aq)△H=+43.5kJ?mol-1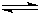 HCN(aq)+OH-(aq)的△H=
HCN(aq)+OH-(aq)的△H=查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 弱酸 | CH3COOH | H2SO3 | HCN |
| 物质的量浓度mol/L | 0.01 | 0.01 | 0.01 |
| pH | 3.4 | 2.3 | 5.6 |
| c(H+) |
| c(CH3COOH) |
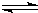
查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江省镇海中学高三学年模拟卷一化学试卷(理综)(5月份)(解析版) 题型:解答题
| 弱酸 | CH3COOH | H2SO3 | HCN |
| 物质的量浓度mol/L | 0.01 | 0.01 | 0.01 |
| pH | 3.4 | 2.3 | 5.6 |
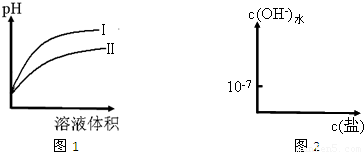
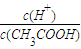 同时增大的是______.
同时增大的是______.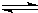 H+(aq)+CN-(aq)△H=+43.5kJ?mol-1
H+(aq)+CN-(aq)△H=+43.5kJ?mol-1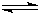 HCN(aq)+OH-(aq)的△H=______.该反应25℃时的平衡常数K=______.
HCN(aq)+OH-(aq)的△H=______.该反应25℃时的平衡常数K=______.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com