
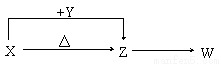
X��Y��Z��W���ֳ������������X��������Ԫ�أ�X��Y��Z����ɫ��Ӧ��Ϊ��ɫ��WΪ��ɫ��ζ���塣�����ֻ������������ת����ϵ(���ַ�Ӧ����P��Ӧ��������ȥ)��
��ش�
��W�Ļ�ѧʽ��____________________��
��X��Y����Һ�з�Ӧ�����ӷ���ʽ��_______________________________��
�Ǣٽ�4.48 L(������Ϊ��״��)Wͨ��100 mL3 mol/L��Y��ˮ��Һ����Һ�е�������________��
����Ȼ���д���X��Z��H2O��һ�������ᾧ���ɵĹ��塣ȡһ�����ù�������ˮ���100 mL��Һ����
����Һ�н��������ӵ�Ũ��Ϊ0.5 mol/L����ȡ��ͬ�����Ĺ�����������أ�ʣ����������Ϊ g��
��1��CO2����2��HCO3-+OH-=CO32-+H2O����3����Na2CO3��NaHCO3�� ��2.65��[��Դ
��������
���������X��Y��Z����ɫ��Ӧ��Ϊ��ɫ��˵�����������߾�Ϊ��Ԫ�صģ�X��������Ԫ�أ��ڼ���������������Z�������ֻ������Ϊ������Ԫ����ɣ���WΪ��ɫ��ζ�����壨��ѧ�γ�������ɫ��ζ������ΪH2��O2��CO2�ȣ������Ƴ�XΪNaHCO3��YΪNaOH��ZΪNa2CO3��WΪCO2����1�������Ϸ�����֪WΪCO2���ʴ�Ϊ��CO2����2��X��Y����Һ�з�Ӧ��NaHCO3+NaOH=Na2CO3+H2O�����ӷ���ʽ��HCO3-+OH-=CO32-+H2O���ʴ�Ϊ��HCO3-+OH-=CO32-+H2O����3����n��CO2��=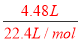 =0.2mol��n��NaOH��=0.3mol������2CO2+3NaOH=Na2CO3+NaHCO3+H2O��������ΪNa2CO3��NaHCO3���ʴ�Ϊ��Na2CO3��NaHCO3������Һ�н��������ӵ�Ũ��Ϊ0.5mol/L��ӦΪ�����ӣ���n��Na+��=0.05mol�����Ⱥ����ΪNa2CO3�� n��Na2CO3��=0.025mol��m��Na2CO3��=0.025mol��106g/mol=2.65g���ʴ�Ϊ��2.65��
=0.2mol��n��NaOH��=0.3mol������2CO2+3NaOH=Na2CO3+NaHCO3+H2O��������ΪNa2CO3��NaHCO3���ʴ�Ϊ��Na2CO3��NaHCO3������Һ�н��������ӵ�Ũ��Ϊ0.5mol/L��ӦΪ�����ӣ���n��Na+��=0.05mol�����Ⱥ����ΪNa2CO3�� n��Na2CO3��=0.025mol��m��Na2CO3��=0.025mol��106g/mol=2.65g���ʴ�Ϊ��2.65��
���㣺������ƶ�


 �ƸԾ���Ȥζ����ϵ�д�
�ƸԾ���Ȥζ����ϵ�д� ����С����ҵ��ϵ�д�
����С����ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
Ϊ̽��п��ϡ����ķ�Ӧ����[��v(H2)��ʾ]����Ӧ������м���ijЩ���ʣ������жϲ���ȷ����
A����������NaCl���壬v(H2)���� B����������ˮ��v(H2)��С
C����������CH3COONa���壬v(H2)���� D����������CuSO4��Һ��v(H2)���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ��һ��ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A��HNO3��Ħ������Ϊ63
B��Ħ�������ʵ����ĵ�λ
C��1 mol�κ����ʶ�Լ����6.02��1023��ԭ��
D��64 g SO2���1mol O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼ��һ���÷Ͼɲ��������Ŀ�����������ߵĵ��ʾ��ͼ��
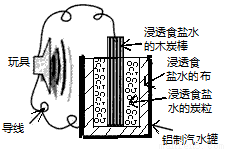
�õ�ع���ʱ���й�˵����ȷ����
A��ľ̿��Ӧ����ߵ���ĸ�������
B��̿����̿���Ϸ����ĵ缫��Ӧ�ǣ�O2+4e-=2O2-
C����������ʴ
D����Ϊһ��ʼ��Ӧ�ͻ����ɴ����������õ����һ����Σ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��Ӧ3A(g)+B(g) 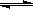 2C(g)+2D(g)���ڲ�ͬ����²�÷�Ӧ�������£����з�Ӧ����������
2C(g)+2D(g)���ڲ�ͬ����²�÷�Ӧ�������£����з�Ӧ����������
A��v (A)=0.15 mol��L-1��s-1 B��v (B)=0.3 mol��L-1��s-1
C��v (C)=0.5 mol��L-1��s-1 D��v (D)=0.4 mol��L-1��s-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������б�������У��һ11��������ѧ�Ծ��������棩 ���ͣ�������
��ͬ��ͬѹ�£�ͬ����ļ��飨CH4���Ͷ�����̼��ԭ������֮��Ϊ ������֮��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������б�������У��һ11��������ѧ�Ծ��������棩 ���ͣ�ѡ����
A2��B2��C2 3�ֵ��ʺ��������Ӽ��ܷ������з�Ӧ2A��+C2=2C��+ A2��2C��+ B2 = 2B�� + C2����X������C2������Ӧ2X�� + C2 = 2C�� + X2 �й�˵���в���ȷ����
A��������B2��C2��A2 B����ԭ��X-��C-��B-
C��X2 ��B�� �ܷ�����Ӧ D��X2 ��B�� ���ܷ�����Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������б�������У��һ11��������ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵���������
A�����ö����ЧӦ�����ֵ�����Һ����������Һ
B��ij���ʾ���ѧ�ⶨֻ����һ��Ԫ�أ�����Զ϶���������һ�ִ�����
C���ù��˷�����ȥFe(OH)3�����е�FeCl3
D�����м���������ƶ������������˽���ľ۳�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ĵ�ʡ�߶��������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪�����������η���E��ֱ���η���G��Ӧ�������������η���L��ֱ���η���M�����E���ӵ�Ԫ�ص�ԭ��������С��10�����G���ӵ�Ԫ��Ϊ��������Ԫ�أ���
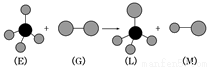
�����ж�����ȷ����
A�����³�ѹ�£�L��һ��Һ̬�л���
B��E�Ķ������ֻ��һ�ֽṹ
C��G����ǿ�����Ժ�Ư����
D��������Ӧ�������Ǽӳɷ�Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com