
纳米是长度单位,1纳米等于1×10-9米,物质的颗粒达到纳米级时,具有特殊的性质。例如将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜” 的有关叙述正确的是( )
A.常温下“纳米铜”比铜片的还原性强,反应时反应速率快
B.“纳米铜”颗粒更细小,化学反应时接触面大,所以反应速率快
C.“纳米铜”与铜是同素异形体
D.常温下“纳米铜”比铜片更易得电子,反应时反应速率快
科目:高中化学 来源:2013-2014四川绵阳中学实验学校高考冲刺理综化学试卷(解析版) 题型:填空题
(15分)已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A原子、C原子的L能层中,都有两个未成对的电子,C、D同主族。 E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
⑴基态D原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 ;
⑵E2+离子的价层电子排布图是 ,F原子的电子排布式是 ;
⑶A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 , B元素的气态氢化物的VSEPR模型为 ;
⑷化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为 ;
⑸配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为 ;
⑹某种化合物由D,E,F三种元素组成,其晶胞如图所示,则其化学式为 ,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度:
d= g/cm3。

查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高二化学试卷(解析版) 题型:选择题
已知:4NH3(g)+5O2(g) == 4NO(g)+6H2O(g) △H=-1 025kJ/mol,该反应是一个可逆反应。若反应物 起始物质的量相同,下列关于该反应的示意图不正确的是( )
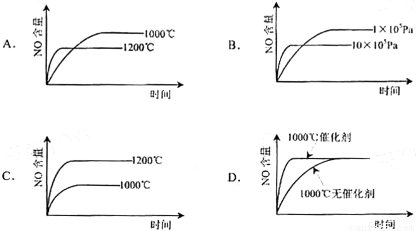
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高一化学试卷(解析版) 题型:选择题
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。则下列说法正确的是( )
A.电池工作时,MnO2发生还原反应
B.电池负极的电极反应式为:2MnO2+H2O+2e-→Mn2O3+2OH-
C.电池工作时,K+移向负极
D.电池工作时,电路中每通过0.1mol电子,锌的质量理论上减少6.5g
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高一化学试卷(解析版) 题型:选择题
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是( )
A.由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-===AlO2-+2H2O
C.由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,消耗铜电极32 g
D.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-===Cu2+
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高一化学试卷(解析版) 题型:选择题
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期主族元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省资阳市高一下学期期末考试化学试卷(解析版) 题型:选择题
(8分)可以将氧化还原反应2H2+O2=2H2O设计成原电池。
(1)利用H2、O2、HCl溶液构成燃料电池,则正极的电极反应式为_________________________
___________;负极的电极反应式为__________________________________。
(2)把H2改成CH4,KOH溶液作电解质,则负极的电极反应式为________________________
_____________,当导线中通过4 mol电子时,需消耗______mol的KOH;将4 mol CH4完全与Cl2发生取代反应,并生成等物质的量的四种氯代物,则理论上需要消耗Cl2的物质的量为_______mol。
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:选择题
已知反应2H2(g)+CO(g)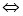 CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,
CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,
测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列大小比较正确的是
平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |
K | 2.50 | 0.34 | 0.15 |
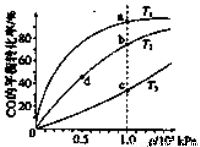
A. 平横常数:K(a)>K(c),K(b)=K(d)
B. 正反应速率:v(a)>v(c),v(b)=v(d)
C. 达到平衡所需时间:t(a)=t(c),t(b)>t(d)
D. 平均相对分子质量:M(a)=M(c),M(b)>M(d)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com