
【题目】H2O2分解速率速率受多种因素影响,实验测得70℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法不正确的是( )
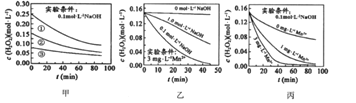
A. 图甲表明,其他条件相同时,![]() 浓度越大,其分解速率越快
浓度越大,其分解速率越快
B. 图甲![]() 和图乙因起始浓度不同不能比较
和图乙因起始浓度不同不能比较![]() 存在对化学反应速率的影响
存在对化学反应速率的影响
C. 图丙表明,![]() 作催化剂时,浓度越大催化
作催化剂时,浓度越大催化![]() 分解效果越好
分解效果越好
D. 图乙和图丙表明,相同条件下对![]() 分解速率受
分解速率受![]() 影响大
影响大
【答案】B
【解析】
A.图甲中溶液的pH相同,但浓度不同,浓度越大,相同时间内浓度的变化量越大,由此得出相同pH条件下,双氧水浓度越大,双氧水分解速率越快,选项A正确;
B.图甲中实验条件是0.1mol/L的氢氧化钠溶液中,图乙中少量Mn2+存在时,相同时间内双氧水浓度变化量:0.1mol/LNaOH溶液>1.0mol/LNaOH溶液>0mol/LNaOH溶液,由此得出:锰离子作催化剂时受溶液pH的影响,但与溶液的pH值不成正比,能比较Mn2+存在对化学反应速率的影响,选项B错误;
C.图丙表明,Mn2+作催化剂时,浓度越大催化H2O2分解效果越好,选项C正确;
D.图丙中pH相同,锰离子浓度越大,相同时间内双氧水浓度变化量越大,图乙中说明催化剂的催化效率受溶液的pH值影响,由此得出:碱性溶液中,Mn2+对H2O2分解速率的影响大,选项D正确;
答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】向50mLNaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol·L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是
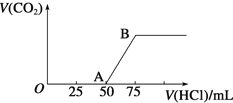
A. OA段所发生反应的离子方程式:H+ + OH-= H2O
B. 产生的CO2体积(标准状况下)为0.056L
C. 原NaOH溶液的物质的量浓度为0.75mol·L-1
D. NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知分解1molH2O2放出热量98kJ,在含少量I-的溶液中,H2O2分解的机理为H2O2+I-→H2O+IO-(慢)、 H2O2+IO-→H2O+O2+I-(快)。 下列有关该反应的说法不正确的是( )
A. 总反应中![]() :
:![]() :1
:1
B. ![]() 的分解速率与的
的分解速率与的![]() 浓度有关
浓度有关
C. 该反应的催化剂是![]() ,而不是
,而不是![]()
D. 由于催化剂的加入降低了反应的活化能,使该反应活化能低于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】准确称取6.0 g铝土矿样品(主要成分为Al2O3,含Fe2O3杂质),加入100 mL稀硫酸中,充分反应后向滤液中加入10 mol·L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如图所示。则所用硫酸物质的量浓度为( )

A. 3.50 mol·L-1
B. 1.75 mol·L-1
C. 0.85 mol·L-1
D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作②的名称是______________,试剂a的溶质是_______________(填化学式)
(2)加入试剂b所发生反应的化学方程式为___________________________________。
(3)该方案能不能达到实验目的:_____________,若不能,应如何改进?(若能,此问不用回答)________________________________________。
(4)用分离出的固体B配制100mL 0.5mol/L的溶液B,现有如下可供选择的仪器:
A.胶头滴管 B.烧瓶 C.烧杯 D.药匙 E.量筒 F.托盘天平。
①用托盘天平称得固体B的质量是_________g。
②配制溶液B时,上述仪器中一定不需要使用的有_____________(填字母),还缺少的仪器有__________________________________(写仪器名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化气作为洁净液体燃料使用。工业上以CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应:
①CO(g)+2H2(g)CH3OH(g)△H1=-91kJmol-1
②2CH3OH(g)CH3OCH3(g)+H2O(g)△H2=-24kJmol-1
③CO(g)+H2O(g)CO2(g)+H2(g)△H3=-41kJmol-1
回答下列问题:
(1)写出新工艺的总反应的热化学方程式:______
(2)某温度下在2L恒容密闭容器中加入CH3OH发生反应②,测得有关数据如下:
反应时间/min | 0 | 1 | 2 | 3 | 4 |
n(CH3OH)/mol | 1.02 | 0.42 | 0.22 | 0.02 | 0.02 |
①反应在2min内以CH3OCH3表示的化学反应速率为______
②该温度下的反应的平衡常数为______
(3)一定条件下的密闭容器中,在总反应达到平衡前,要使在单位时间内提高CO的转化率,可以采取的措施是______
A 增大压强 B 加入催化剂C 减少CO2的浓度 D 降低体系温度
(4)为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果CO转化率随温度变化的规律如图1,试解释原因:______
(5)该研究者还测定了相同条件下氢气的残留量,请在图2中划出H2的残留量随温度变化的曲线______

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G对白色念珠菌具有较强的抑制作用。G可经下图所示合成路线制备:

请回答下列问题:
(1) A→B的反应类型是________。
(2) E中含氧官能团的名称为________和________。
(3) C与B互为同分异构体,能与小苏打反应放出CO2,且能与SOCl2发生取代反应生成D。写出C的结构简式:________。
(4) 写出同时满足下列条件的D的一种同分异构体的结构简式:________。(不考虑立体异构)
①含有—SH结构;
②能在酸性条件下发生水解反应,两种水解产物均含有三种不同环境的H原子。其中一种水解产物既能遇FeCl3溶液显色,又能与Br2的CCl4溶液发生加成反应。
(5) 写出以甲苯和乙醇为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯及其化合物的用途广泛,例如:“84”消毒液的有效成分是次氯酸钠,漂白精的有效成分是次氯酸钙,洁厕剂的有效成分是盐酸。已知酸性: H2CO3>HClO>HCO3-。下列有关说法正确的( )
A. “84”消毒液与洁厕剂混合使用,能增强漂白或去污效果
B. 工业上制取漂白粉往往是向澄清石灰水中通入足量氯气
C. 可设计实验装置,用电解饱和食盐水的方法制备次氯酸钠溶液
D. 向“84”消毒液中通入少量CO2,反应的化学方程式为2NaClO+CO2+H2O==Na2CO3+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4 kJ·mol-1。在恒容密闭容器内,投入2mol N2和6mol H2发生反应,当反应达到平衡状态时,下列说法不正确的是
2NH3(g) △H=-92.4 kJ·mol-1。在恒容密闭容器内,投入2mol N2和6mol H2发生反应,当反应达到平衡状态时,下列说法不正确的是
A. 当其他条件不变的情况下,升高温度,原有的平衡被破坏,逆反应速率增大,正反应速率减小
B. 一定存在2v(H2)正=3 v(N2)逆
C. 反应过程中可能放出92.4 kJ的热量
D. 容器内混合气体的平均相对分子质量不再发生变化时,说明反应达到平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com