
| A. | 质子数:c>b | B. | 氢化物的稳定性:H2Y<HZ | ||
| C. | 离子的还原性:Y2-<Z- | D. | 原子半径:r(X)<r(W) |
分析 元素周期表前三周期元素的离子aW2+、bX+、cY2-、dZ-具有相同电子层结构,核外电子数相等,所以a-3=b-1=c+2=d+1,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Mg元素,X为Na元素,结合元素周期律解答.
解答 解:元素周期表前三周期元素的离子aW2+、bX+、cY2-、dZ-具有相同电子层结构,核外电子数相等,所以a-3=b-1=c+2=d+1,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Mg元素,X为Na元素,
A.由以上分析可知c=8,b=11,则质子数c<b,故A错误;
B.非金属性F>O,非金属性越强氢化物越稳定性,氢化物稳定性为H2O<HF,故B正确;
C.非金属性F>O,非金属性越强,对应的单质的氧化性越强,则阴离子的还原性越弱,则离子还原性O2->F-,故C错误;
D.W为Mg元素,X为Na元素,同周期随原子序数增大原子半径减小,故原子半径Na>Mg,故D错误.
故选B.
点评 本题考查原子结构与元素周期律的相关知识,难度不大,可以根据电子层结构确定在周期表中的位置关系,从而推断其性质,不需确定具体的元素.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:选择题
| 操作 | 目的 | |
| A | 食醋浸泡水垢 | 比较乙酸和碳酸的酸性强弱 |
| B | 向蔗糖溶液中加入稀硫酸,水浴加热,5min后向其中加入新制Cu(OH)2的悬浊液,加热. | 证明蔗糖水解产物中有葡萄糖 |
| C | 向NaBr溶液中加入少量氯水,振荡后加入少量四氯化碳,振荡,静置. | 比较氯、溴非金属性强弱 |
| D | 钠分别与水和乙醇反应 | 乙醇羟基中氢原子不如水分子中氢原子活泼 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
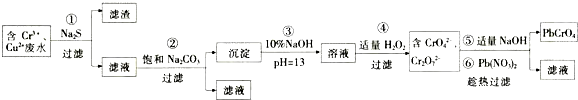
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
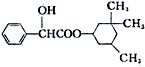 环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如图.下列对该物质的叙述中,正确的是( )
环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如图.下列对该物质的叙述中,正确的是( )| A. | 该物质属于芳香烃 | |
| B. | 该有机物不能被氧化成醛 | |
| C. | 分子式为C17H23O3 | |
| D. | 1mol该物质最多可与2 mol NaOH发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
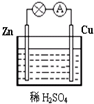 (1)Zn极为原电池的负(填“正”或“负”)极,该极的电极反应式是Zn-2e-=Zn2+,属于氧化反应(填“氧化反应”或“还原反应”).Cu极的电极反应式是2H++2e-=H2↑,
(1)Zn极为原电池的负(填“正”或“负”)极,该极的电极反应式是Zn-2e-=Zn2+,属于氧化反应(填“氧化反应”或“还原反应”).Cu极的电极反应式是2H++2e-=H2↑,查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)NF3分子中N原子的杂化轨道类型为sp3,该分子的空间构型为三角锥形
(1)NF3分子中N原子的杂化轨道类型为sp3,该分子的空间构型为三角锥形查看答案和解析>>
科目:高中化学 来源: 题型:选择题
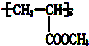 ,这种醇的结构简式为( )
,这种醇的结构简式为( )| A. | CH2═CHCH2OH | B. | CH3CH2OH | C. | CH3CH(OH)CH2OH | D. | CH2ClCHClCH2OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com