
| A. | 0.45 mol/(L•s) | B. | 0.15 mol/(L•s) | C. | 0.225 mol/(L•s) | D. | 0.9 mol/(L•s) |
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 正反应生成NO2的速率和逆反应生成O2的速率相等 | |
| B. | N2O4和NO2的浓度相等 | |
| C. | 混合气体的颜色保持不变 | |
| D. | 单位时间内生成1mol O2的同时,生成1molNO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
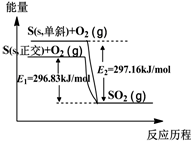
| A. | 单斜硫和正交硫互为同素异形体 | |
| B. | 正交硫比单斜硫稳定 | |
| C. | 相同物质的量的正交硫比单斜硫所含有的能量高 | |
| D. | 由单斜硫制取正交硫是一个放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子间通过共用电子对所形成的化学键叫共价键 | |
| B. | 成键原子间原子轨道重叠越多,共价键越牢固 | |
| C. | 对双原子分子来讲,键能越大,含有该键的分子越稳定 | |
| D. | 键长越长,化学键越牢固 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
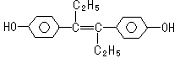
| A. | 该药物可以用有机溶剂萃取 | |
| B. | 该有机物可与NaOH和NaHCO3发生反应 | |
| C. | 1mol该有机物可以与5mol Br2发生反应 | |
| D. | 该有机物分子中,可能有16个碳原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 原子半径:丙>丁>戊 | B. | 金属性:甲>丙 | ||
| C. | 氢氧化物碱性:丙>丁>戊 | D. | 最外层电子数:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com