
常温下,将0.1 mol·L-1NaOH溶液与0.06 mol·L-1 H2SO4溶液等体积混合,该混合溶液的pH等于
A.1.7 B.2.0 C.12.0 D.12.4
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列说法正确的是( )
A.活化分子间所发生的碰撞为有效碰撞
B.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大的主要原因是增加了单位体积内活化分子的百分数
D.有气体参与的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子总数,从而使反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
有关碰撞理论,下列说法中不正确的是( )
A.具有足够能量的分子(活化分子)相互碰撞就一定能发生化学反应
B.增大反应物浓度,单位体积内活化分子数增多,有效碰撞的几率增大,反应速率增大
C.升高温度,活化分子百分数增大,有效碰撞的几率增大,反应速率增大
D.正催化剂能降低反应的活化能,提高活化分子百分数,有效碰撞的几率增大,反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
在10L容器中,加入2mol的SO2(g)和2mol的NO2(g),保持温度恒定,发生反应:
SO2(g)+ NO2(g) 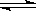 SO3(g)+NO(g)。当达到平衡状态时,测得容器中SO2(g)的转化率为50%。
SO3(g)+NO(g)。当达到平衡状态时,测得容器中SO2(g)的转化率为50%。
试求:该温度下、该容器中,再继续加入1mol的SO2(g),则:
(1)化学平衡将向________方向移动,NO2的转化率将____________;
(2)经计算,当达到新的平衡状态时,容器中SO2(g)的浓度是_______mol/L;
(3)整个过程中,SO2的转化率由50%变为_______%,NO2的转化率由__________%变为_______%。
(4)计算结果给我们的启示是:增大一种反应物物的用量,其转化率将________________(填“增大” 、“不变”或“减小”)另一反应物的转化率将____________(填“增大” 、“不变”或“减小”)。现实生产中的意义是:可以通过增大________的用量,来提高成本高的反应物的利用率。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列电离方程式中书写正确的是
A.NaHSO4  Na++H++SO42- B.NaHCO3
Na++H++SO42- B.NaHCO3  Na++H++CO32-
Na++H++CO32-
C.HClO = H++ClO- D.H2S  H++HS-;HS-
H++HS-;HS-  H++S2-
H++S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
取c(H+)均为0.01 mol/L的盐酸和醋酸各100mL分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是
① 醋酸与锌反应放出氢气多 ② 盐酸和醋酸分别与锌反应放出的氢气一样多
③ 盐酸与锌反应放出氢气多 ④ 盐酸和醋酸分别与锌反应的速度一样大
⑤ 醋酸与锌反应速率大 ⑥ 盐酸与锌反应速率大
A.①⑥ B.②⑤ C.③④ D.①⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com