
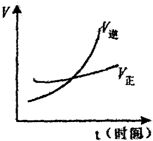
| A. | m>n | B. | m<n | C. | m=n | D. | 无法确定 |
科目:高中化学 来源: 题型:选择题
| A. | CSO的电子式: | |
| B. | Cl-的结构示意图: | |
| C. | 甲烷分子的比例模型: | |
| D. | 原子核内有20个中子的氯原子:2017Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu→Cu2(OH)CO3 | B. | HCl→Cl2 | C. | Fe2O3→Fe | D. | Al(OH)3→Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
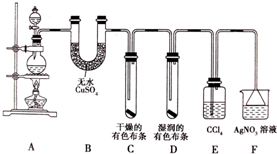 某化学实验兴趣小组为探究实验室制备Cl2 的过程中有水蒸气和HCl挥发来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略):
某化学实验兴趣小组为探究实验室制备Cl2 的过程中有水蒸气和HCl挥发来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| B. | 钠与水的反应Na+2H2O=Na++2OH-+H2↑ | |
| C. | 铜片跟稀硝酸反应:Cu+NO3-+4H+═Cu2++NO↑+2H2O | |
| D. | 铝片和氢氧化钠溶液反应:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
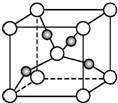 生物质能是一种洁净、可再生能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.
生物质能是一种洁净、可再生能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室利用如图装置进行中和热的测定,请回答下列问题:
实验室利用如图装置进行中和热的测定,请回答下列问题:| 反应物 | 起始温度t1/°C | 终了温度t2/°C | 中和热 |
| HCl+NaOH | 13 | 19.8 | △H1 |
| HCl+NH3•H2O | 13 | 19.3 | △H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com