
| A. | 正、逆反应速率都增大,平衡不移动 | |
| B. | 正、逆反应速率都不变,平衡不移动 | |
| C. | 正、逆反应速率都增大,平衡向左移动 | |
| D. | 正、逆反应速率都增大,平衡向右移动 |
分析 若保持温度不变,向容器中再加入1mol A、0.5mol B和1mol C,可以等效为在原平衡的基础上增大压强到达的平衡,正反应为气体体积减小的反应,与原平衡相比,增大压强平衡向正反应方向移动,正逆反应速率都加快,由此分析解答.
解答 解:A、增大压强,正、逆反应速率都增大,平衡正向移动,而不是不移动,故A错误;
B、增大压强,正、逆反应速率都增大,并不是不变,平衡正向移动,而不是不移动,故B错误;
C、正、逆反应速率都增大,平衡向右移动,故C错误;
D、增大压强,正、逆反应速率都增大,平衡正向移动,故D正确;
故选D.
点评 本题考查化学平衡的有关计算、影响化学平衡的因素,难度中等,构建平衡建立的途径是关键,注意等效思想的运用.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | 被氧化的HCl为0.4mol | B. | 转移的电子数为0.2NA | ||
| C. | 该反应中HCl只作还原剂 | D. | Cl2为还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 纳米材料是指一种称为“纳米”的新物质制成的材料 | |
| B. | 绿色食品是指不含任何化学物质的食品 | |
| C. | 光导纤维是以二氧化硅为主要原料制成的 | |
| D. | 合成纤维的主要原料是石油、天然气、煤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅是良好的半导体材料,可以与NaOH 溶液和氢氟酸反应 | |
| B. | 二氧化硅与石灰石反应:SiO2+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO↑ | |
| C. | 用焦炭还原二氧化硅生产硅:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO2↑ | |
| D. | 工业制造镁粉是将镁蒸气在某气体中冷却,CO2可作为冷却气体. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
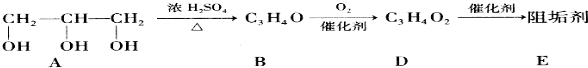
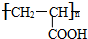 ;其反应类型为加聚反应;
;其反应类型为加聚反应;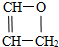 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该周期有32种元素 | |
| B. | 该周期的元素,原子序数最大为118 | |
| C. | 该周期的ⅦA族元素是金属元素 | |
| D. | 该周期的ⅢA族元素的氢氧化物具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:1 | B. | 1:3 | C. | 2:3 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
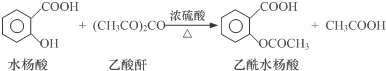
| 试剂 | 沸点(℃) | 溶解度 | 化学性质 |
| 水杨酸 | 211 | 微溶于冷水,易溶于热水 | |
| 乙酸酐 | 139 | 在水中逐渐分解 | |
| 乙酰水杨酸 | 微溶于水 | 与碳酸钠反应生成水溶性盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO | B. | O3 | C. | CO2 | D. | 氟氯烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com