
【题目】今年是门捷列夫发现元素周期律150周年。下表为元素周期表的一部分。
碳 | W | Y | |
X | 硫 | Z |
回答下列问题:
(1)X元素的名称是______________。
(2)Y元素的氢化物H2Y的稳定性_____________(填“>”或“<”)H2S。
(3)表中元素的最高价氧化物对应的水化物酸性最强的是____________(填化学式)。
(4)写出W的最高价含氧酸的稀溶液与足量铁粉反应的离子方程式_____________。
(5)碳与镁可形成化合物M,若1molM与水反应生成2 mol Mg(OH)2和1mol烃N,N分子中碳氢质量比为9:1, M与水反应的化学方程式为___________。
【答案】硅 > HClO4 3Fe + 2NO3- + 8H+ = 3Fe2+ + 2NO↑ + 4H2O Mg2C3 + 4H2O = 2Mg(OH)2 + C3H4↑
【解析】
由周期表的简单结构可知,与碳同主族的X元素为Si,与碳同周期的W元素为N,Y元素为O,硫的右侧为Cl,由此进行分析作答。
(1)由周期表的简单结构可知,与碳同主族的X元素为Si,名称为硅;
(2) Y元素为O,与S同主族,同主族从上到下非金属性逐渐减弱,氢化物的稳定性逐渐减弱,因此Y元素的氢化物H2Y的稳定性大于H2S;
(3)表中元素的最高价氧化物对应的水化物酸性最强的是HClO4;
(4)W元素为N,最高价含氧酸的稀溶液为稀硝酸,与足量铁粉反应生成硝酸亚铁、NO和水,离子方程式为3Fe + 2NO3- + 8H+ = 3Fe2+ + 2NO↑ + 4H2O;
(5) 1molM与水反应生成2 mol Mg(OH)2和1mol烃N,而N分子中碳氢质量比为9:1,因此![]() =
=![]() ,因此N为C3H4,由此可知M的化学式为Mg2C3,因此M与水反应的化学方程式为Mg2C3 + 4H2O=2Mg(OH)2 + C3H4↑。
,因此N为C3H4,由此可知M的化学式为Mg2C3,因此M与水反应的化学方程式为Mg2C3 + 4H2O=2Mg(OH)2 + C3H4↑。


科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可以从牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍 | 试通过计算填空: (1)A的相对分子质量为__。 |
将9.0gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g | (2)A的分子式为__。 |
另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团__、__。 |
A的核磁共振氢谱如图:
| (4)A中含有__种氢原子。 综上所述,A的结构简式为__。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:形成KBr晶体时的能量变化如图所示,下列说法正确的是
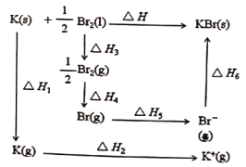
A.△H1<0,△H2<0
B.△H3-△H4<0
C.△H6=△H3+△H4+△H5-△H
D.△H=△H1+△H2-△H3-△H4-△H5-△H6
查看答案和解析>>
科目:高中化学 来源: 题型:
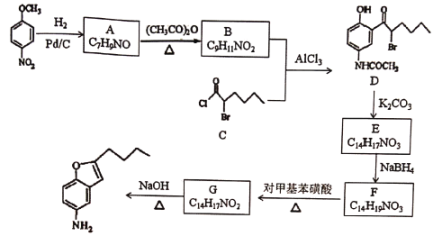
【题目】化合物H是合成一种药物的中间体,可通过以下方法合成:
已知:①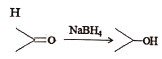 ②
②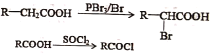
(1)化合物F的结构简式_____。
(2)下列说法正确的是_____。
A. 由反应物转化为A,E转化为F均发生了还原反应
B. 化合物F中有2个手性碳原子
C. 1molG能与5molH2发生加成反应
D.化合物H的分子式为C12H15NO
(3)写出D→E的化学方程式______。
(4)请写出以正己醇为原料制备化合物C的流程图,无机试剂任选。________________
(5)写出同时满足下列条件的B的所有同分异构体的结构简式______。①分子中只有4种不同化学环境的氢②分子中不含氮氧键、C=O③分子中只有一个环状结构,且遇FeCl3溶液显紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.通过丁达尔效应可以区分蔗糖溶液和蛋白质溶液
B.用![]() 等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可减少“白色污染”
等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可减少“白色污染”
C.干燥的氯气能使品红溶液褪色
D.3D打印技术以钛合金粉末为原料,通过激光熔化逐层堆积,来制造精密的钛合金结构件,高温时可用金属钠还原相应的氯化物溶液来制取金属钛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】色香味俱佳、口感好的食品深受人们的喜爱。为了提高食品的质量,在生产过程中往往会加入一些能改变食品某些性质的物质。请按照题意要求填空:
(1)某课外小组学生学做比萨饼, 购买了下列食物:①西红柿、②食盐、③橄榄油④小麦粉.请回答:
其中富含淀粉的是________(填序号,下同),富含油脂的是________,富含维生素的是________,属于调味剂的是________;
(2)味精是常用的一种鲜味剂,其有效成分是谷氨酸钠,它的结构简式如下图,该物质分子中所含的官能团有________和________ (填写名称); 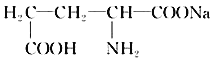
(3)碳酸氢钠是常见的疏松剂,主要是因为它在加热条件下产生了气体,使食品变得疏松。试写出碳酸氢钠受热分解的化学方程式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的化学用语表达正确的是( )
A. 乙烯的结构简式:CH2CH2 B. 羟基的电子式:![]()
C. 甲醇的球棍模型:![]() D. 乙酸的实验式:CH3COOH
D. 乙酸的实验式:CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】膳食纤维具有突出的保健功能,是人体的“第七营养素”。木质素是一种非糖类膳食纤维,其单体之一——芥子醇结构简式如图所示。下列有关芥子醇的说法正确的是( )
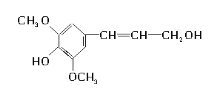
A.芥子醇分子中含9种不同化学环境的H原子
B.芥子醇分子中所有碳原子不可能在同一平面上
C.芥子醇属于芳香族化合物,分子式是C11H12O4
D.芥子醇能发生的反应类型有氧化、取代、加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京市场销售的某种食用精制盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
分装时期 | |
分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
____KIO3+___KI+___H2SO4=___K2SO4+___I2+___H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是_________________________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是______________________。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是______________________。
②b中反应所产生的I2的物质的量是___________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
_______________________mg/kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com