
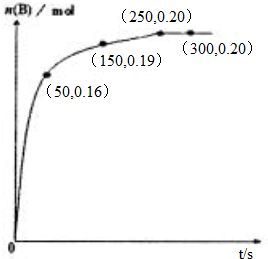
| A. | 0~50秒,A物质化学反应速率v(A)=0.0016mo 1•L-1•S-1 | |
| B. | 250s时该反应达到化学平衡状态 | |
| C. | 若改加入2.0mol A,A的平衡转化率大于20% | |
| D. | 300K时,该反应的平衡常数为0.025 mol•L-1 |
分析 A.由图可知,0~50s 内B的浓度变化量为$\frac{0.16mol}{2L}$=0.08mol/L,根据v=$\frac{△c}{△t}$计算v(B),根据速率之比等于计量数之比计算A的速率;
B.由图可知,250s时该反应中B的物质的量不再随时间变化而变化,据此判断;
C.根据图可计算充入1.0mol A,A的平衡转化率,若改加入2.0mol A,容器体积不变,相当于对原平衡体系加压,平衡逆向移动,据此判断;
D.由图可知,250s时达到平衡,平衡时c(B)=0.1mol/L,利用三段式计算平衡时各组分的浓度,代入平衡常数表达式计算,据此解答.
解答 解:A.由图可知,0~50s 内B的浓度变化量为$\frac{0.16mol}{2L}$=0.08mol/L,根据v=$\frac{△c}{△t}$计算得v(B)=$\frac{0.08}{50}$mo 1•L-1•S-1=0.0016mo 1•L-1•S-1,根据速率之比等于计量数之比计算得A的速率为0.0016mol/(L•s),故A正确;
B.由图可知,250s时该反应中B的物质的量不再随时间变化而变化,所以反应达到化学平衡状态,故B正确;
C.根据图可计算充入1.0mol A,根据化学方程式,达到平衡时A的转化的物质的量与生成B的物质的量相等,为0.2mol,所以A的平衡转化率为20%,若改加入2.0mol A,容器体积不变,相当于对原平衡体系加压,平衡逆向移动,A的平衡转化率小于20%,故C错误;
D.由图可知,250s时达到平衡,平衡时c(B)=0.1mol/L,则:
A(g)?B(g)+C(g)
开始(mol/L):0.5 0 0
变化(mol/L):0.1 0.1 0.1
平衡(mol/L):0.4 0.1 0.1
故该温度下平衡常数k=$\frac{0.1×0.1}{0.4}$=0.025mol•L-1,故D正确;
故选C.
点评 本题考查化学平衡图象、化学反应速率计算、平衡常数计算、化学平衡影响因素等,难度中等,注意D选项中三段式的应用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 同位素 | B. | 同分异构体 | C. | 同系物 | D. | 同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I2Cl6 | B. | ICl5 | C. | HClO | D. | KIO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加入物质 | HCl(aq) | FeCl3 | NaOH | HCOONa | C2H5OH |
| 溶液的pH | 3 | 4 | 10 | 11 | 未确定 |
| 水的电离程度 | α1 | α2 | α3 | α4 | α5 |
| A. | α3>α1>α5>α2>α4 | B. | α4>α2>α5>α1>α3 | C. | α4>α2>α5>α3>α1 | D. | α1>α3>α5>α2>α4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
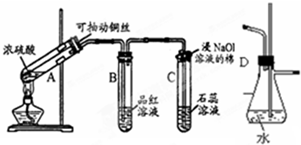 根据如图所示实验回答下列问题:
根据如图所示实验回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性:HI>HBr>HCl>HF | |
| B. | 晶体熔点:金刚石>SiC>NaCl>Na>Mg>Al | |
| C. | 酸性:HClO4>H2SO4>H2SO3>HClO | |
| D. | 晶格能:MgF2>NaCl>NaBr |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理:
苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理: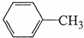 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +2MnO2↓+KOH+H2O
+2MnO2↓+KOH+H2O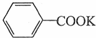 +HCl→
+HCl→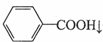 +KCl
+KCl| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 溶解度 | |
| 不溶 | 乙醇 | ||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 不溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4(100℃升华) | 25℃0.35g 80℃,2.7g | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下的22.4 L辛烷完全燃烧,生成二氧化碳分子数为8 NA | |
| B. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成水分子数为3 NA | |
| C. | 常温常压下,22.4 L甲烷中含C-H键的数目为4NA | |
| D. | 常温常压下,3g甲醛分子中含电子数1.6 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com