
分析 A、B、C、D、E都为短周期元素,A是相对原子质量最小的,则A为H元素;B的+1价阳离子和C的-1价阴离子都与氖原子具有相同的电子层排布,则B为Na元素,C为F元素;D在C的下一周期,可与B形成BD型离子化合物,则D为Cl元素;E和C为同一周期元素,其最高价氧化物的水化物为强酸,则E为N元素,据此进行解答.
解答 解:A、B、C、D、E都为短周期元素,A是相对原子质量最小的,则A为H元素;B的+1价阳离子和C的-1价阴离子都与氖原子具有相同的电子层排布,则B为Na元素,C为F元素;D在C的下一周期,可与B形成BD型离子化合物,则D为Cl元素;E和C为同一周期元素,其最高价氧化物的水化物为强酸,则E为N元素,
(1)B的+1价阳离子与氖原子具有相同的电子层结构,所以B是金属Na,在第三周期第ⅠA族,
故答案为:三;ⅠA;
(2)E和F为同一周期元素,其最高价氧化物对应的水化物为一种强酸即为硝酸,所以E是N,E的氢化物是氨气,10电子结构,所含电子总数相等的分子有H2O、CH4、HF等,离子有Na+、O2-、OH-、Mg2+、Al3+等,
故答案为:H2O(CH4、HF);OH-(Mg2+、Al3+、Na+、O2-);
(3)A是相对原子质量最小的元素即为H,H和F形成的化合物HF是含有共价键的共价化合物,
故答案为:共价键;
(4)D的单质为氯气,B的最高价氧化物对应的水化物为NaOH,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O,
故答案为:Cl2+2OH-=ClO-+Cl-+H2O;
(5)A、E分别为H、N元素,二者形成的化合物为NH3,实验室制备氨气是利用氯化铵和氢氧化钙固体加热生成氯化钙、氨气和水,反应的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
点评 本题考查了位置结构与性质关系的应用,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题侧重考查学生的分析能力及灵活应用能力.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
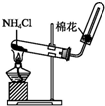
| A. | 氨和铵盐都易溶于水,都能生成NH4+ | |
| B. | 铵态氮肥与碱性物质如草木灰混合施用肥效更高 | |
| C. | 实验室制备氨气的试剂和装置可为如图装置 | |
| D. | 工业上用氨气液化需吸收热量的过程做制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
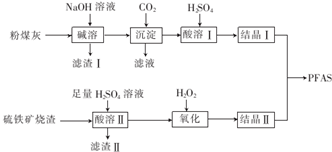
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
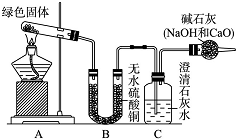 铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究.查阅相关资料后,猜想该绿色物质可能是铜的碳酸盐.
铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究.查阅相关资料后,猜想该绿色物质可能是铜的碳酸盐.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用丁达尔效应鉴别NaCl溶液和KCl溶液 | |
| B. | 向某溶液中加入BaCl2溶液出现白色沉淀,则该溶液中肯定有SO42- | |
| C. | 用KSCN溶液鉴别FeCl2溶液和Fe2(SO4)3溶液 | |
| D. | 用焰色反应可鉴别出NaCl、KCl和Na2SO4三种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
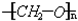 ,是通过加聚反应制得的,合成人造象牙的单体是HCHO
,是通过加聚反应制得的,合成人造象牙的单体是HCHO查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10 -1 | 1.7×10 -5 | 6.2×10 -10 | K1=4.3×10-7 K2=5.6×10-11 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,44 g C3H8中含有的碳碳单键数为3NA | |
| B. | 1mol碳正离子CH3+所含的电子数为6NA | |
| C. | 室温下的乙烯和丁烯共21.0g,其中碳原子数为1.5NA | |
| D. | 标准状况下,1L 庚烷完全燃烧后,所生成的气态产物分子数为$\frac{7}{22.4}$NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com