
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 组成元素 | B、C | A、C | A、D | C、D |
| 1mol×22.4L/mol |
| 5.6L |
| 1 |
| 2 |
| 1 |
| 2 |
| 0.112L |
| 22.4L/mol |
| 0.02mol |
| 0.2L |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、在一定温度下,AgCl水溶液中Ag+和Cl-浓度的乘积是一个常数 |
| B、催化剂都不参与化学反应,反应前后质量、组成和性质都保持不变 |
| C、应用盖斯定律,可间接计算某些难以直接测量的反应热 |
| D、由于分子间氢键的存在,第VA族氢化物的沸点大小关系为:NH3>SbH3>AsH3>PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
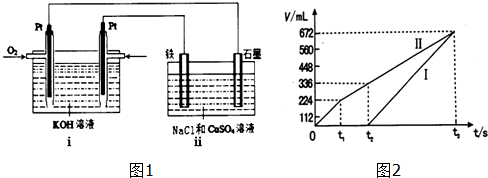
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
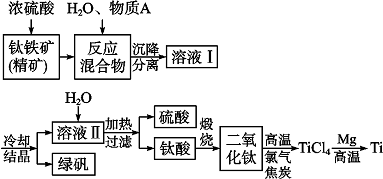
查看答案和解析>>
科目:高中化学 来源: 题型:
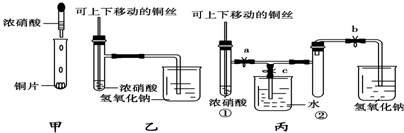
查看答案和解析>>
科目:高中化学 来源: 题型:
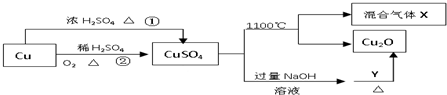
| A、相对于途径①,途径②更好地体现了绿色化学思想 |
| B、Y可以是葡萄糖溶液 |
| C、CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 |
| D、将CuSO4溶液蒸发浓缩,冷却结晶可制得胆矾晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
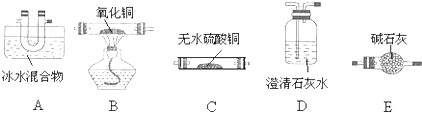
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、未加入NaOH溶液时,原HA溶液中c(H+)=c(OH-)+c(A-) |
| B、向原溶液中滴入少量NaOH溶液,离子浓度可能为:c(A-)>c(Na+)>c(H+)>c(OH-) |
| C、当滴入的NaOH与HA恰好完全中和时,溶液中c(Na+)=c(A-) |
| D、当加入过量的NaOH溶液时,溶液可能呈中性,也可能呈碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com