
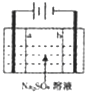
 近来人们开发了通过电解同时生产NaOH和H2SO4的化学工艺,现在用离子交换膜(a、b)和石墨作电极的电解池进行生产模根,下列主产法中不正确的是( )
近来人们开发了通过电解同时生产NaOH和H2SO4的化学工艺,现在用离子交换膜(a、b)和石墨作电极的电解池进行生产模根,下列主产法中不正确的是( )| A、阴极反应式4OH--4e-=2H2O+O2↑ |
| B、阴极得到NaOH,阳极得到H2SO4 |
| C、每生产1molH2SO4,同时得到2mol NaOH |
| D、此反应实质就是电解水 |


科目:高中化学 来源: 题型:
| A、乙烯通往Br2的CCl4溶液中生成1,2---二溴乙烷 |
| B、乙醇在空气中燃烧生成CO2和H2O |
| C、用氯乙烯制聚氯乙烯 |
| D、甲烷与氯气混合后光照生成一氯甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | ||
| B、等浓度等体积的NaHSO3溶液与NaClO溶液混合后:c(Na+)+c(H+)=c(HSO3-)+c(ClO-)+2c(SO32-)+c(OH-) | ||
C、等浓度等体积的NaHCO3溶液与NaCl溶液混合后:
| ||
| D、标况下,将2.24L SO2气体通入到100ml 1mol?L-1的NaOH溶液中,完全反应后溶液呈酸性,则该溶液中:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁为负极,锌为正极 |
| B、铁为阳极,锌为阴极 |
| C、用可溶性铁盐作电解液 |
| D、锌元素既被氧化又被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在任何条件下,化学平衡常数K都是一个定值 |
| B、当改变反应物的浓度时,化学平衡常数会发生改变 |
| C、化学平衡常数K只与温度有关,与反应物浓度、体系的压强无关 |
| D、化学平衡常数K与反应物的转化率是一一对应的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
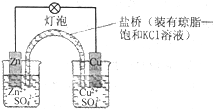
| A、盐桥中的Cl-移向CuSO4溶液 |
| B、电池总反应为Zn+Cu2+=Zn2++Cu |
| C、在外电路中,电子从正极流向负极 |
| D、取下盐桥,原电池仍可工作 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com