
| A. | 当a=2b时,反应后的粒子浓度之比:c(Fe2+):c(I-):c(Cl-)=1:1:1 | |
| B. | 当3a=2b时,发生的离子反应:2Fe2++4I-+3Cl2═2Fe3++2I2+6Cl- | |
| C. | 当13a=2b时,发生的离子反应:2Fe2++4I-+13Cl2+12H2O═4IO3-+26Cl-+2Fe3++24H+ | |
| D. | 若反应后溶液中I2与IO3-的物质的量为1:1,则反应中转移的电子3.5b mol |
分析 可见还原性强弱顺序为:I->Fe2+>I2,所以不断通Cl2的过程中,依次发生以下氧化还原反应:Cl2+2I-=2Cl-+I2、Cl2+2Fe2+=2Fe3++2Cl-、5Cl2+I2+6H2O=2IO3-+12H++10Cl-.当n(Cl2):n(FeI2)=1:1时,I-恰好全被氧化;当n(Cl2):n(FeI2)=1.5时,Fe2+正好全被氧化;当n(Cl2):n(FeI2)=6.5时,氧化还原反应完毕,由此分析解答.
解答 解:A、当a=2b时,则碘离子的物质的量为:4bmol,而bmol Cl2消耗2bmol的I-,生成2bmolCl-,所以反应后的粒子浓度之比:c(Fe2+):c(I-):c(Cl-)=1:1:1,故A正确;
B、当3a=2b时,也就是b=1.5amol,1.5amolCl2得到3amol的电子,所以Fe2+正好全被氧化,且亚铁离子与碘离子要符合组成之比为1:2,则离子反应的方程式为:2Fe2++4I-+3Cl2═2Fe3++2I2+6Cl-,故B正确;
C、当13a=2b时,也就是b=6.5amol,氧化还原反应完毕,2Fe2++4I-+13Cl2+12H2O═4IO3-+26Cl-+2Fe3++24H+,故C正确;
D、若反应后溶液中I2与IO3-的物质的量为1:1,说明亚铁离子完全被氧化,amol的FeI2,所以amol的碘离子氧化成碘单质,另外amol的碘离子氧化成碘酸根离子,所以转移电子的物质的量为:2amol+6amol=8amol,故D错误;
故选D.
点评 本题考查离子反应及氧化还原反应,把握氧化性、还原性强弱确定离子反应的先后顺序为解答的关键,明确每一条折线代表的物质及对应的反应即可解答,题目难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子核内有18个中子的氯原子:${\;}_{17}^{35}$Cl | |
| B. | 硫原子的原子结构示意图: | |
| C. | 溴化氢的电子式: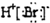 | |
| D. | 乙酸的分子式:CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
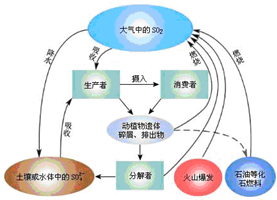
| A. | 大气中SO2含量过高降雨时会形成酸雨 | |
| B. | 为减少化石能源中煤燃烧产生的SO2,可向其中加入生石灰 | |
| C. | 从火山爆发到形成土壤或水体中的SO42-过程中,硫元素均被还原 | |
| D. | 有机硫化物存在于石油和动植物体内,说明含硫有机物和含硫无机物可以相互转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠块在氯气中燃烧,产生白烟 | |
| B. | 将氯水滴入紫色石蕊试液中,试液先变红后褪色 | |
| C. | 用pH试纸测得0.1mol•L-1硫酸铝溶液显中性 | |
| D. | 向新切土豆上滴加碘水,土豆片上显示蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.常见物质的鉴别 | B.环境保护 |
| 羊毛和化纤--点燃后闻气味 磷矿粉和氯化铵--观察颜色 硬水和软水--加肥皂水搅拌 | 白色污染--只对人的视觉感观有影响 温室效应--对大气环境有影响 重金属污染--对人体内蛋白质有影响 |
| C.化学与生活 | D.化学中常见的“三” |
| 汽油去油污与洗涤剂去油污--原理相同 蛋白质与油脂--组成元素相同 合金与纯金--硬度相同 | H2、C、CO2--三种具有还原性的物质 分子、原子、离子--三种构成物质的粒子 棉花、羊毛、天然橡胶--三大天然有机高分子材料 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某电解装置如图所示,电解槽内装有淀粉KI溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现右侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O.下列说法不正确的是( )
某电解装置如图所示,电解槽内装有淀粉KI溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现右侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O.下列说法不正确的是( )| A. | 石墨电极与电源的正极相连 | |
| B. | 刚开始电解时,左侧溶液的pH增大 | |
| C. | 电解结束时,右侧溶液中含有I- | |
| D. | 电解槽内发生反应的总化学方程式为2KI+2H2O═I2+H2↑+2KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下与足量18mol/LH2SO4反应,最多可放出0.6molH2 | |
| B. | 常温下与足量2mol/LHNO3反应,最少可放出0.45molH2 | |
| C. | 常温下与足量2mol/LH2SO4反应,放出H2的量在0.45mol~0.6mol之间 | |
| D. | 常温下与足量2mol/LNaOH反应,放出H2的量在0.45mol~0.6mol之间 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com