
| 1 |
| 2 |
| 1 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、②③ | B、①④ |
| C、①⑤ | D、①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、全部 | B、除②⑦以外 |
| C、除②以外 | D、除⑨以外 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:| 方法a | 用炭粉在高温条件下还原CuO | ||||
| 方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O; | ||||
| 方法c | 电解法,反应为2Cu+H2O
| ||||
| 方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 光照 |
| Cu2O |
| 序号 | 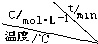 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强电解质溶液一定比弱电解质溶液的导电性强 |
| B、强电解质的水溶液中不存在分子 |
| C、SO2和乙醇均属共价化合物,在水中都不能电离,均属非电解质 |
| D、不同的弱电解质只要物质的量浓度相同,电离程度也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
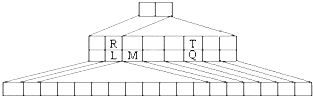 如图是另一种元素周期表--三角形元素周期表的一部分,图中标示了L、M、Q、R、T元素的位置,下列判断正确的是:( )
如图是另一种元素周期表--三角形元素周期表的一部分,图中标示了L、M、Q、R、T元素的位置,下列判断正确的是:( )| A、Q、T两元素的氢化物的稳定性为HnT<HnQ |
| B、L、R的单质与盐酸反应速率为R>L |
| C、M与T形成的化合物有两性 |
| D、L、Q形成的简单离子核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)工业酸性废水中含Cr2O72-离子会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气.结果溶液的PH值不断升高,溶液由酸性转变为碱性.Cr2O72-转化为毒性较低的Cr3+的离子方程式为:
(1)工业酸性废水中含Cr2O72-离子会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气.结果溶液的PH值不断升高,溶液由酸性转变为碱性.Cr2O72-转化为毒性较低的Cr3+的离子方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:A>B>C>D |
| B、原子序数:d>c>b>a |
| C、离子半径:C3->D->B+>A2+ |
| D、元素的第一电离能:A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com